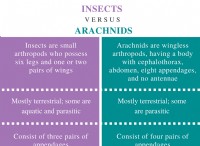
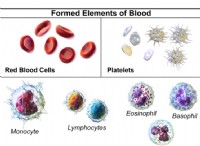
その理由は次のとおりです。
* モルは物質の量の尺度です。 酸のモルの数は、存在する酸の質量によって決定されます。これは、水の量に関係なく同じままです。
* 希釈は酸の濃度のみを変化させます。 濃度は、単位体積あたりの酸の量です。水を加えると、溶液の量が増加し、酸の濃度が減少しますが、存在する酸の総量は変わりません。
例:
1リットルの水に1モルの塩酸(HCl)が溶解していると想像してください。この溶液の濃度は1 m(1リットルあたり1モル)です。さらに1リットルの水を加えると、2リットルの溶液がありますが、それでも1モルのHClしかありません。濃度は0.5 m(2リットルあたり1モル)に減少しましたが、HClのモル数は同じままです。
重要な注意: 酸のモルの数は同じままですが、モル 溶液の(リットルあたりのモル)希釈により変化します。