1。イオン結合:
*反対に帯電したイオン間の静電引力によって形成されます。
*金属と非金属の間で発生します。
* 1つの原子は電子を失います(積極的に帯電します)、もう1つの原子は電子を獲得します(負に帯電します)。
*例:NaCl(塩化ナトリウム)
2。共有結合:
* 2つの原子間で電子の共有によって形成されます。
*非金属間で発生します。
*極地にすることができます (部分電荷につながる電子の不平等な共有)または非極性 (電子の平等な共有)。
*例:H₂O(水)、CO₂(二酸化炭素)
3。金属債:
*金属にあります。
*電子は非局在化されており、金属格子全体で自由に移動できます。
*導電率、順応性、延性などの金属の特性を担当します。
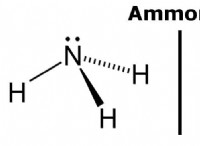
4。水素結合:
*特別なタイプの双極子 - 双極子相互作用。
*高強性原子(酸素、窒素、またはフッ素など)に結合した水素原子と別の電気陰性原子の電子ペアとの間に発生します。
*水、タンパク質、およびDNAの構造に重要な役割を果たします。
5。ファンデルワールス力:
*電子分布の一時的な変動から生じる弱い分子間力。
*ロンドンの分散部隊、双極子双極子の相互作用、水素結合を含めます。
*分子を液体と固体にまとめる責任があります。
これらの主なタイプに加えて、調整共有結合のような弱いタイプの結合もあります およびイオン共有結合 そのものは、イオン結合と共有結合の両方の特性を示します。
化学結合の強度は大きく異なることに注意することが重要です。イオンおよび共有結合は、一般に水素結合およびファンデルワールスの力よりも強いです。これらの強度の違いは、物質の特性に重要な意味を持ちます。