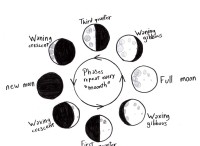
酸と塩と水を生成するベースの間の反応。
より詳細な説明を次に示します。
* 酸 溶液中の水素イオン(H+)を放出する物質です。
* ベース 溶液中に水酸化物イオン(OH-)を放出する物質です。
*酸と塩基が反応すると、水素イオンと水酸化物イオンが結合して水を形成します(H2O)。
*酸と塩基からの残りのイオンを組み合わせて塩を形成します 。
例:
塩酸(HCl) +水酸化ナトリウム(NAOH)→塩化ナトリウム(NaCl) +水(H2O)
* HClは酸で、H+イオンを放出します。
* NaOHはベースであり、オハイオンを放出します。
* NaClは形成された塩です。
* H2Oは形成された水です。
中和反応に関する重要なポイント:
*発熱性であり、熱を放出します。
*溶液のpHは、酸性(低pH)から塩基性(高いpH)またはその逆に変化します。
*溶液が中性(pH 7)の場合、反応のエンドポイントに到達します。
*中和反応は、以下を含む多くのアプリケーションで重要です。
*酸と塩基の濃度を決定するための滴定。
*塩の生産。
*産業プロセスにおけるpHの制御。