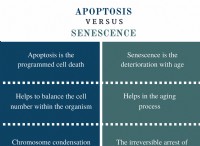
酸
* 強酸: 溶液中に完全にイオン化します。つまり、すべての陽子を水に寄付します。例:塩酸(HCl)、硫酸(H₂SO₄)、硝酸(HNO₃)
* 弱酸: 溶液中に部分的にのみイオン化します。つまり、それらは一部の陽子のみを寄付します。例:酢酸(Ch₃COOH)、炭酸酸(H₂CO₃)、クエン酸(C₆H₈O₇)
ベース
* 強いベース: 溶液中に完全に解離し、陽子を受け入れる水酸化物イオン(OH-)を放出します。例:水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化バリウム(BA(OH)₂)
* 弱いベース: 溶液中に部分的にのみ解離し、より少ない水酸化物イオンを放出します。例:アンモニア(nh₃)、メチルアミン(ch₃nh₂)、ピリジン(c₅h₅n)
強度に影響する要因
* 結合強度: 酸性陽子と残りの分子の間の強い結合により、陽子を供与するのが難しくなり、酸が弱くなります。
* 電気陰性度: より多くの電気陰性の原子は、酸性プロトンから電子密度を引き離し、寄付が容易になり、酸が強くなります。
* 共鳴: 酸の共役ベースが共鳴によって安定化できる場合、酸の強度を高めます。
酸とベース強度の測定
* pHスケール: 溶液の酸性度またはアルカリ度を測定する0〜14のスケール。 pH値が低いことは酸性度が高いことを示しますが、pH値が高いほどアルカリ度が高くなります。
* pka: 酸解離定数(KA)の負の対数は、酸が溶液中にイオン化する程度を測定します。 PKA値の低下は、より強い酸を示します。
* pkb: 塩基分離定数(KB)の負の対数は、溶液中の塩基がイオン化する程度を測定します。 PKB値の低下は、より強い塩基を示します。
キーポイント
*強酸と塩基は溶液中に完全にイオン化しますが、弱酸と塩基は部分的にしかイオン化しません。
*酸またはベースの強度は、陽子を寄付または受け入れる能力によって決まります。
*さまざまな要因は、結合強度、電気陰性度、共鳴など、酸またはベースの強度に影響します。
* pHスケール、PKA、およびPKBは、酸と塩基の強度を測定するために使用されます。