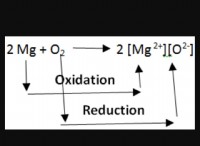
1。活性化エネルギー:
*すべての化学反応には、活性化エネルギーと呼ばれる一定量のエネルギーが必要です。反応物が衝突して生成物を形成するためには必要です。
*触媒は、より低い活性化エネルギーを持つ代替反応経路を提供します。これは、より多くの反応物分子が活性化障壁を克服し、反応するのに十分なエネルギーを持っていることを意味します。
2。作用メカニズム:
*触媒は通常、反応物と相互作用し、一時的な中間体を形成します。
*これらの中間体は、その後の反応ステップの活性化エネルギーが低い。
*製品が形成されると、触媒が放出され、別の反応サイクルに参加できます。
3。触媒の種類:
* 均質触媒: 反応物と同じ段階に存在します(たとえば、生物系の酵素)。
* 不均一触媒: 反応物とは異なる相に存在します(たとえば、気相反応における固体触媒)。
4。キーポイント:
*触媒は反応の平衡位置を変えません。それらは、平衡に達する速度にのみ影響します。
*それらは、触媒する反応に非常に特異的です。
*少量の触媒でさえ、反応速度に大きな影響を与える可能性があります。
例:
* 酵素: 生物の無数の生化学反応を促進する生物学的触媒。
* 触媒コンバーター: 有害な排気ガスをあまり有害な物質に変換するために車で使用されます。
* ニッケル触媒: マーガリンを産生するために植物油の水素化に使用されます。
要約すると、触媒は、反応が進行するのに必要な活性化エネルギーを低下させることにより、化学反応を加速します。彼らは、エネルギー要件が低い代替反応経路を提供し、最終的に消費されずにプロセスを高速化することでそうします。