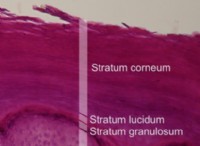
その理由は次のとおりです。
* イオン化合物: クロム(III)酢酸塩はイオン化合物であり、積極的に帯電したクロムイオン(cr³⁺)と負に帯電した酢酸イオン(Ch₃Coo⁻)で構成されています。
* 極性溶媒: 水は極性溶媒です。つまり、電子の不均一な共有により、正と負の端があります。この極性により、イオン化合物の荷電イオンと相互作用することができます。
* 溶解度: 水分子と酢酸クロム(III)のイオンとの間の引力は、イオン自体間の魅力を克服するのに十分な強さであり、溶解につながります。
ただし、注意することが重要です:
* 溶解度は相対的な用語です: Chromium(III)水への酢酸塩の溶解度はそれほど高くありません。ニュートラルな水よりも酸性溶液の方が溶けます。
* 水和イオンの形成: クロム(III)アセテートが水に溶解すると、イオンは水分子に囲まれ、水分補給イオンを形成します。これは、溶液中のイオン化合物を備えた一般的な現象です。
他に質問がある場合はお知らせください!