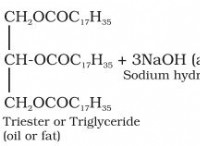その理由は次のとおりです。
* 金属 電子を失い、正に帯電したイオン(陽イオン)を形成する傾向があります。
* 非金属 電子を獲得し、負に帯電したイオン(アニオン)を形成する傾向があります。
金属と非金属が反応すると、金属原子は電子を非金属原子に失い、反対に帯電したイオン間に静電引力を生み出します。この魅力は、イオンを結晶格子構造にまとめて、イオン化合物を形成します。
例:
*ナトリウム(Na)は金属であり、塩素(Cl)は非金属です。
*ナトリウムは1つの電子を失い、ナトリウムイオン(Na+)になります。
*塩素は1つの電子を獲得して塩化物イオン(Cl-)になります。
*これらのイオンは互いに引き付けられ、テーブル塩とも呼ばれるイオン化合物ナトリウム(NaCl)を形成します。
例外:
金属と非金属間のほとんどの反応はイオン化合物を形成しますが、例外があります。
* 遷移金属 関与する非金属に応じて、イオンと共有特性の両方を持つ化合物を形成できます。
* いくつかの金属非金属の組み合わせ 特に2つの要素間の電気陰性度の違いが小さい場合、共有化合物を形成できます。
全体として、イオン化合物は、金属と非金属の間の反応の最も一般的な結果です。