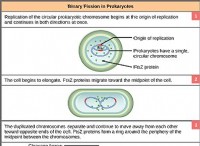
重要な概念
* エネルギーレベル: 原子内の電子は特定のエネルギーレベルに存在し、しばしば核を囲むシェルとして視覚化されます。
* sublevels: 各エネルギーレベルには、電子のエネルギーと空間分布をさらに定義するサブレベル(S、P、D、F)があります。
* 軌道: 各サブレベルには、電子が見つかる可能性が高い空間の領域である1つ以上の原子軌道が含まれています。
2番目のエネルギーレベルの電子
* エネルギーレベル: 2番目のエネルギーレベル(2番目のシェルとも呼ばれます)は、原子の最初の励起状態です。
* sublevels: 2番目のエネルギーレベルには2つのサブレベルがあります。
* 2s: このサブレベルには、最大2つの電子を保持できる1つの軌道があります。
* 2p: このサブレベルには3つの軌道があり、それぞれが最大2つの電子を保持できます。これは、2Pサブレベルが合計6つの電子を保持できることを意味します。
* 総容量: 2番目のエネルギーレベルは、最大 8つの電子を保持できます (2秒のサブレベルに2つ、2pのサブレベルで6つ)。
例:酸素
酸素には8つの電子があります。その電子構成は1s²2s²2pp°です。 これはつまり:
* 2つの電子が1S軌道(最初のエネルギーレベル)を満たします。
* 2つの電子が2S軌道(2番目のエネルギーレベル)を満たします。
* 4つの電子が3つの2p軌道(2番目のエネルギーレベル)を満たします。
重要な注意: 2番目のエネルギーレベルの電子の正確な数は、要素によって異なります。ただし、最大容量は8つの電子のままです。