主な違い 正常ヘモグロビンと鎌状赤血球ヘモグロビンの違いは、 さらに、正常なヘモグロビンでは、グルタミン酸は親水性が強く、バリンは鎌状赤血球ヘモグロビンをより疎水性にします。さらに、正常なヘモグロビンは、赤血球が静脈を自由に流れるように両凹形状にするのに対し、鎌状赤血球ヘモグロビンは、鎌状赤血球を三日月状にし、静脈の分岐点に付着させます。
正常なヘモグロビンと鎌状赤血球ヘモグロビンは、ほぼすべての脊椎動物の赤血球に含まれる鉄含有酸素輸送金属タンパク質であるヘモグロビンの 2 つの構造形態です。一般に、ヘモグロビン A は正常なヘモグロビンの最も一般的な形態であり、鎌状赤血球ヘモグロビンはヘモグロビン S として知られています。
対象となる主な分野
1. 正常ヘモグロビンとは
– 定義、構造、重要性
2. 鎌状赤血球ヘモグロビンとは
– 定義、構造、重要性
3. 正常ヘモグロビンと鎌状赤血球ヘモグロビンの類似点
– 共通機能の概要
4. 正常ヘモグロビンと鎌状赤血球ヘモグロビンの違い
– 主な相違点の比較
主な用語
ヘモグロビン A、ヘモグロビン S、正常ヘモグロビン、鎌状赤血球貧血、鎌状赤血球ヘモグロビン 
正常なヘモグロビンとは
通常、脊椎動物の赤血球には正常なヘモグロビンが存在します。具体的には、ヘモグロビン A (ヘモグロビン A1 または α2 β2 ) 赤血球の 95% に存在する最も一般的なタイプの正常なヘモグロビンです。また、2 つのアルファ サブユニットと 2 つのベータ サブユニット (α2 β2 )。それとは別に、ヘモグロビン A2 とヘモグロビン F は、成人の正常なヘモグロビンの他のマイナーなタイプです。
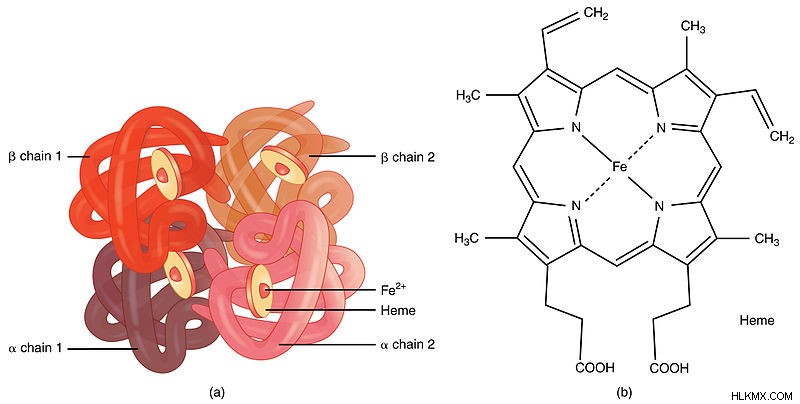
図 1:ヘモグロビンの構造
さらに、ヘモグロビンは、赤血球中の鉄含有酸素輸送金属タンパク質です。それは 4 つの球状タンパク質の集合体であるため、各タンパク質鎖は非タンパク質 補欠分子ヘム グループと会合します。通常、ヘム基は、ポルフィリンとして知られる複素環に保持された鉄(Fe)イオンで構成されています。また、ヘモグロビンの主な機能は、肺から全身に酸素を運ぶことです。それに加えて、二酸化炭素を肺に運びます。
鎌状赤血球ヘモグロビンとは
鎌状赤血球ヘモグロビンは、正常なヘモグロビンの変異体です。鎌状赤血球ヘモグロビンの一種であるヘモグロビンSは、β鎖遺伝子に変異があり、ヘモグロビンの性質が変化して赤血球が鎌状になります。ここで、鎌状赤血球ヘモグロビンには単一の点突然変異が含まれており、6 位でグルタミン酸(E/Glu)をバリン(V/Val)に置換しています(E6V 置換)。通常、グルタミン酸はより親水性で、バリンはより疎水性です。したがって、これにより新しい疎水性スポットが作成されます。
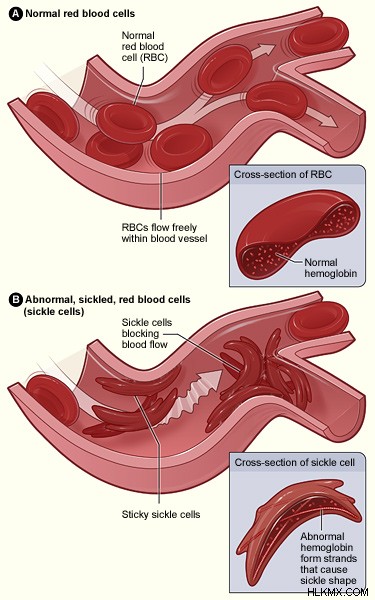
図 2:正常赤血球と鎌状赤血球
さらに、脱酸素状態では、正常ヘモグロビンと鎌状赤血球ヘモグロビンの両方の疎水性スポットが互いに付着し、鎖状に凝集します。しかし、鎌状赤血球ヘモグロビンのアミノ酸組成は、正常なヘモグロビンとまったく同じではありません。したがって、この凝集は鎌状赤血球ヘモグロビンで異なります。その上、ベータ鎖のバリンは別の疎水性パッチに結合します。最終的に、これにより、鎌状赤血球ヘモグロビン四量体が互いにくっついて長い繊維を形成します。そのため、独立したままではなく、重合化します。その結果、重合した鎌状赤血球ヘモグロビンは、鎌状赤血球を異常な鎌状に変形させます。
重要なことに、酸素濃度が低いと、鎌状赤血球は静脈の分岐点でくっつく傾向があります。また、ヘテロ接合体は、ヘモグロビン A とヘモグロビン S の混合物を持っています。通常、この状態は「鎌状赤血球形質」として知られています。対照的に、ホモ接合状態は鎌状赤血球貧血につながります。
正常ヘモグロビンと鎌状赤血球ヘモグロビンの類似点
- 正常ヘモグロビンと鎌状赤血球ヘモグロビンは2つヘモグロビンの構造形態。
- 一般的に、ヘモグロビンは鉄を含むすべての脊椎動物の赤血球に存在する金属タンパク質。
- また、四次構造が作られていますマルチサブユニット球状タンパク質のアップ。
- それらの機能は、体から酸素を運ぶことです。肺から血液を通して全身へ。
正常ヘモグロビンと鎌状赤血球ヘモグロビンの違い
定義
正常なヘモグロビンは血液中の酸素運搬色素を指し、赤血球の主要なタンパク質であり、鎌状赤血球ヘモグロビンは異常なヘモグロビンの最も一般的な形態を指し、鎌状赤血球形質と鎌状赤血球貧血の両方の基礎。
ヘモグロビンの種類
正常なヘモグロビンのタイプには、成人のヘモグロビン A、ヘモグロビン A2、およびヘモグロビン F が含まれますが、鎌状赤血球ヘモグロビンのタイプはヘモグロビン S です。
アミノ酸レベルの違い
正常なヘモグロビンはベータ鎖の表面の 6 位にグルタミン酸を含みますが、鎌状赤血球ヘモグロビンでは同じ位置でバリンがグルタミン酸を置き換えます。
アミノ酸置換の効果
グルタミン酸は通常のヘモグロビンで強い親水性を示しますが、バリンは鎌状赤血球ヘモグロビンをより疎水性にします。
重合
酸素濃度が低いと、正常なヘモグロビンは重合しにくくなりますが、鎌状赤血球ヘモグロビンは重合して結晶になり、赤血球が鎌状に歪む傾向があります。
赤血球の形
正常なヘモグロビンは赤血球を両凹形にするのに対し、鎌状赤血球ヘモグロビンは赤血球を三日月形にします。
低酸素濃度下での溶解度
正常なヘモグロビンは低酸素濃度下でより溶けやすく、鎌状赤血球ヘモグロビンは溶けにくくなります。
静脈を流れる
正常なヘモグロビンは、赤血球が静脈を自由に流れることを可能にしますが、鎌状赤血球ヘモグロビンは、静脈の分岐点で鎌状赤血球を粘着させます。
効果
正常なヘモグロビンの変異はヘモグロビン症とサラセミアを引き起こし、鎌状赤血球ヘモグロビンは鎌状赤血球症と鎌状赤血球貧血を引き起こします。
結論
正常なヘモグロビンは、正常な血液細胞に存在するヘモグロビンの一種です。一般に、ヘモグロビン A は、成人の正常なヘモグロビンの最も一般的な形態です。その上、正常なヘモグロビンは重合を受けず、正常な赤血球が両凹構造を維持することを可能にします。したがって、酸素濃度が低い場合、正常な赤血球は静脈を自由に浮遊します。対照的に、鎌状赤血球ヘモグロビンは、ベータ鎖の表面の 6 位のグルタミン酸をバリンに置き換えた、正常なヘモグロビンの突然変異です。その結果、これは鎌状赤血球ヘモグロビンをより疎水性にし、ヘモグロビン四量体を重合させ、通常の両凹形状を鎌形状に変形させます。さらに、低酸素濃度下では、このタイプのヘモグロビンは静脈の分岐点で粘着性になります。最終的に、鎌状赤血球ヘモグロビンは鎌状赤血球貧血を引き起こします。したがって、正常ヘモグロビンと鎌状赤血球ヘモグロビンの主な違いは構造と効果です。
参考文献:
1. ドリスコル、ティモシー。 「鎌状ヘモグロビン」
2. ヘモグロビンのチュートリアル。
2. 「ヘモグロビン S 分子 – 鎌状赤血球貧血の原因は?」 World of Molecules はこちらから入手できます。
画像提供:
1. OpenStax College による「1904 Hemoglobin」 – Anatomy &Physiology、Connexions Web サイト。 (CC BY 3.0) コモンズ ウィキメディア経由
2. 「鎌状赤血球 01」国立心肺血液研究所 (NHLBI) (パブリック ドメイン)、コモンズ ウィキメディア経由







