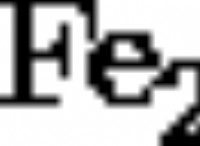一言で言えば、イオン結合:
* 電子の伝達: イオン結合は、1つの原子が1つまたは複数の電子(正の帯電イオンになるか、陽イオンになる)を別の原子に放棄すると、それらの電子(負の帯電イオン、または陰イオンになる)を断ります。
* 静電引力: イオンの反対の電荷は、互いを強く引き付け、安定した化合物を作成します。
イオン結合の識別:
1。電気陰性の違いを見てください:
*電気陰性度は、電子を引き付ける原子の能力の尺度です。
*大きな電気陰性度の違い(一般に1.7以上)は、ある原子が別の原子から電子を採取する傾向が強いことを示します。
2。原子の種類を考慮してください:
* 金属 電子を失い、陽イオンになる傾向があります。
* 非金属 電子を獲得し、アニオンになる傾向があります。
例:
* ナトリウム(Na)および塩素(Cl): ナトリウムの電気陰性度は低く、塩素は電気陰性度が高いです。ナトリウムは容易に1つの電子を失い、Na+になり、塩素はその電子を獲得してCl-になります。 これらの反対に帯電したイオンは、塩化ナトリウム(NaCl)、テーブル塩を形成するために引き付けます。
重要な注意: より多くの電気陰性原子は、常に電子を獲得し、陰イオンになるものです。
特定の原子のペアを分析して、イオン結合を形成するかどうかを確認してください!