沸点の簡単な定義 つまり、液体が沸騰する温度です。たとえば、海面での水の沸点は 100 °C または 212 °F です。科学における正式な定義では、沸点は液体の蒸気圧がその環境の蒸気圧と等しくなる温度です。この温度で、液体は蒸気 (ガス) 相に変化します。
沸騰と蒸発の違い
沸騰と蒸発の両方で、液体は蒸気に移行します。違いは、すべて 液体の沸点で蒸気に変わり始めます。沸騰している液体の中にできる泡は、この蒸気です。対照的に、蒸発では、表面の液体分子だけが蒸気として逃げます。これは、界面にこれらの分子を保持するのに十分な液体圧力がないためです。蒸発は幅広い温度範囲で発生しますが、温度が高く圧力が低いほど蒸発が速くなります。ガスが蒸気で飽和すると、蒸発が止まります。たとえば、空気の湿度が 100% になると水の蒸発は止まります。
沸点に影響する要因
物質の沸点は一定ではありません。それが依存する主な要因は圧力です。たとえば、大気圧が低い高地では水が低温で沸騰するため、レシピに高地での調理方法が表示されます。部分真空まで圧力を下げると、水は室温で沸騰します。
沸点に影響を与えるもう 1 つの重要な要因は、純度です。液体中の汚染物質やその他の不揮発性分子は、沸点上昇と呼ばれる現象で沸点を上昇させます。不純物は液体の蒸気圧を下げ、沸騰する温度を上げます。たとえば、水に少量の塩や砂糖を溶かすと、沸点が上がります。温度の上昇は、追加する塩または砂糖の量によって異なります。
一般に、液体の蒸気圧が高いほど沸点は低くなります。また、イオン結合を持つ化合物は、共有結合を持つ化合物よりも沸点が高くなる傾向があり、共有結合が大きい化合物は、小さな分子よりも沸点が高くなります。極性化合物は、他の要因が等しいと仮定すると、非極性分子よりも沸点が高くなります。分子の形状は沸点にわずかに影響します。コンパクトな分子は、表面積の大きい分子よりも沸点が高くなる傾向があります。
標準沸点 vs 標準沸点
沸点には、標準沸点と標準沸点の 2 種類があります。 通常の沸点 または大気圧の沸点 気圧または海抜 1 気圧での沸点です。 標準沸点 は、1982 年に IUPAC によって定義されたように、圧力が 1 バールのときに沸騰が発生する温度です。水の標準沸点は、圧力 1 バールで 99.61 °C です。
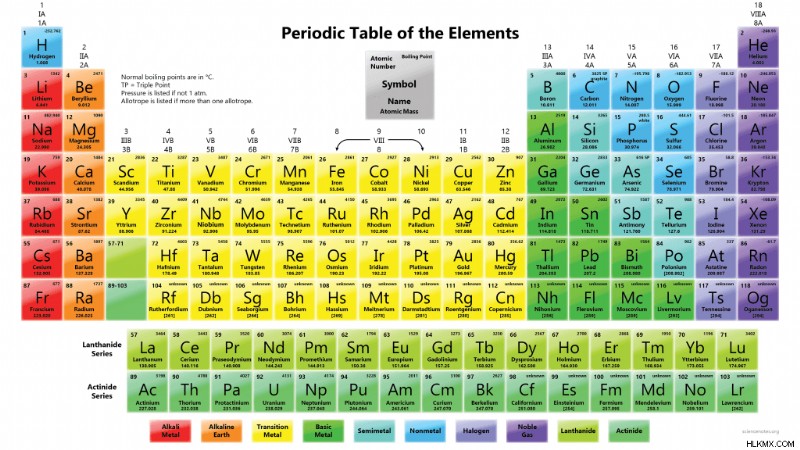
元素の沸点
この周期表は、化学元素の通常の沸点値を示しています。ヘリウムは沸点が最も低い元素です (4.222 K、-268.928 °C、 -452.070 °F)。レニウム (5903 K、5630 °C、 10,170 °F) およびタングステン (6203 K、5930 °C、 10706 °F) は非常に高い沸点を持っています。正確な条件によって、これら 2 つの元素のどちらが沸点が最も高いかが決まります。標準大気圧では、タングステンは沸点が最も高い元素です。
参考文献
- Cox, J.D. (1982). 「状態とプロセスの表記法、化学熱力学における標準という言葉の意味、および熱力学関数の一般的に作表された形式に関する注意事項」. 純粋化学と応用化学 . 54 (6):1239–1250。 doi:10.1351/pac198254061239
- デヴォー、ハワード (2000). 熱力学と化学 (第 1 版)。プレンティスホール。 ISBN 0-02-328741-1.
- Goldberg, David E. (1988). 3,000 の化学の問題 (第 1 版)。マグロウヒル。 ISBN 0-07-023684-4.
- Perry, R.H.;グリーン、D.W.、編。 (1997)。 ペリーの化学エンジニアのハンドブック (第7版)。マグロウヒル。 ISBN 0-07-049841-5.