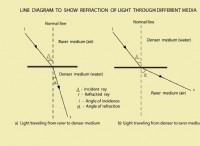
1。酸性環境: 血液が酸性になりすぎると(低pH)、血液中に過剰な水素イオン(H+)があります。
2。重炭酸イオンは緩衝液として作用します: 重炭酸ナトリウムは水に溶解し、重炭酸塩イオン(HCO3-)を放出します。これらのイオンは緩衝液として機能します。つまり、過剰な酸性度を中和するために水素イオン(H+)を受け入れることができます。
3。中和反応: 重炭酸イオン(HCO3-)は、過剰な水素イオン(H+)と反応して炭酸酸(H2CO3)を形成します。この反応は、次の方程式で表されます。
HCO3- + H +→H2CO3
4。炭酸酸分解: 炭酸酸(H2CO3)は不安定で、二酸化炭素(CO2)と水(H2O)に容易に分解します。この分解は、酵素炭酸脱水酵素によって触媒されます。
H2CO3→CO2 + H2O
5。 CO2は吐き出されます: 次に、生成された二酸化炭素は肺から吐き出し、血流からそれを除去します。
全体として、このプロセスは、過剰な水素イオンの中和と血液中の正常なpHバランスの回復をもたらします。
このプロセスの重要性:
- 血液pHの維持: このプロセスは、細胞や臓器の適切な機能に不可欠な狭い範囲内(7.35-7.45)内で血液のpHを維持するために重要です。
- アシドーシスの防止: 血液が酸性になりすぎると(アシドーシス)、これは臓器の損傷やcom睡など、さまざまな深刻な健康問題につながる可能性があります。
- バッファリングシステム: 重炭酸塩緩衝システムは、体の全体的な酸塩基バランスシステムの主要な成分であり、代謝プロセスの変動にもかかわらず、適切なpHバランスが維持されます。
注: 重炭酸ナトリウムは血液中の酸を中和するために使用できますが、医療専門家の監督の下でのみ投与されるべきであることに注意することが重要です。重炭酸ナトリウムでの自己治療は危険であり、有害な副作用がある可能性があります。