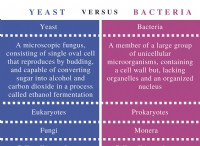
電波(イオン)化合物:
* 構造を固定: イオン化合物は、積極的に帯電した陽イオンと、静電力によって一緒に保持されている負に帯電した陰イオンで構成されています。イオンの配置は、特定の結合配置ではなく、電気中立に必要な電荷の比率によって決定されます。 結晶格子内のイオンの配置に柔軟性はありません。
* 中央原子なし: イオン化合物には中心原子はありません。 多くの場合、異性主義は、中央原子の周りの原子の異なる配置の可能性に依存しています。
* 複数の結合なし: イオン結合は、共有されない電子の伝達によって形成されます。 これは、異なる空間配置を可能にする二重または三重の結合がないことを意味します。
共有化合物:
* 複数の結合の可能性: 共有結合には、電子の共有が含まれ、単一、二重、トリプル結合の形成が可能になります。これにより、中央原子の周りに原子のさまざまな可能な配置が作成されます。
* 中央原子: 共有化合物には、他の原子が結合する中心原子がしばしばあります。これらの周囲の原子の異なる配置は、異なる異性体につながる可能性があります。
* 空間配置: 共有化合物の分子の形状は、結合ペアの数や電子の孤立ペアなどの因子の影響を受けます。これにより、原子のさまざまな空間的配置が可能になり、異性体がつながります。
例:
* イオン: 塩化ナトリウム(NaCl)には、結晶格子内のNa+およびCl-イオンの単純な固定配置があります。 異なる空間的配置の可能性はありません。
* 共有結合: ブタン(C4H10)は、N-ブタン(ストレートチェーン)とイソブタン(分岐鎖)の2つの異性体として存在します。これらの異性体は、分子構造が異なるため、異なる特性を持っています。
要約すると、電動化合物には、異なる原子のさまざまな配置の形成を可能にする構造的柔軟性と結合特性がありません。これは異性性の基礎です。