主な違い – 単原子イオンと多原子イオン
単原子および多原子という用語は、分子またはイオンの原子性を表します。原子数は、分子またはイオンに存在する原子の数です。これが単原子イオンと多原子イオンの主な違いです。単原子イオンは単一の原子で構成されていますが、多原子イオンはイオンごとに 2 つ以上の原子で構成されています .これらのイオンは、陽イオンまたは陰イオンのいずれかです。単原子イオンと多原子イオンの両方が、反対の電荷を持つイオンと静電引力を持つことにより、イオン化合物を形成できます。
対象となる主な分野
1.単原子イオンとは
– 定義、形成、例
2.多原子イオンとは
– 定義、形成、例
3.単原子イオンと多原子イオンの違いは何ですか
– 主な違いの比較
重要な用語:陰イオン、原子性、陽イオン、共有結合、静電引力、元素、イオン、単原子陰イオン、単原子陽イオン、単原子イオン、多原子イオン

単原子イオンとは
単原子イオンは、1 つのイオンに 1 つの原子を含むイオンです。これらは陽イオンまたは陰イオンのいずれかです。一部の原子は、最も外側の電子殻から価電子を取り除くことによってイオンを形成します。これらのイオンは単原子陽イオンです .一部のイオンは、最も外側の電子殻で電子を獲得することによって形成されます。これらは単原子陰イオンとして知られています .次の表は、1 族と 17 族の元素によって形成される単原子イオンを示しています。
| 単原子カチオン | 単原子カチオン |
| リー | F |
| ナ |
|
| K | Br |
| Cs | 私 |
一部の元素は、単原子イオンしか形成できません。しかし、他の元素も多原子イオンを形成できます。単原子イオンは、価電子の数に応じて異なる電荷を持つことができます。たとえば、マグネシウム (Mg) は 2 族の元素で、2 つの価電子を持っています。これらの 2 つの電子を除去することによって、Mg は Mg カチオンを形成できます。それからそれは単原子カチオンです。しかし、希ガスの原子は完全な電子配置で非常に安定しているため、希ガスは単原子イオンを持ちません。
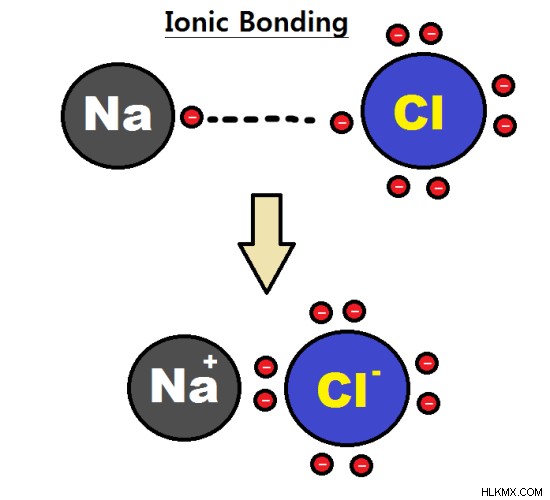
図 1:2 つの単原子イオン間のイオン結合が 2 原子分子を形成
反対の電荷を持つ 2 つの単原子イオン間の結合により、2 原子分子が形成されます。ここで、陽イオンと陰イオンは静電力によって互いに引き寄せられます。たとえば、塩化ナトリウム (NaCl) は、ナトリウム単原子陽イオンと塩化物単原子陰イオンでできています。
多原子イオンとは
多原子イオンは、1 つのイオンが複数の原子から構成されるイオンです。それらは、二原子イオン、三原子イオン、またはその逆のいずれかです。無数の既知の多原子イオンがあります。これらのいくつかは生物系に存在します。自然に発生するイオンもあれば、合成イオンもあります。それらは非常に有用な多原子イオンです。
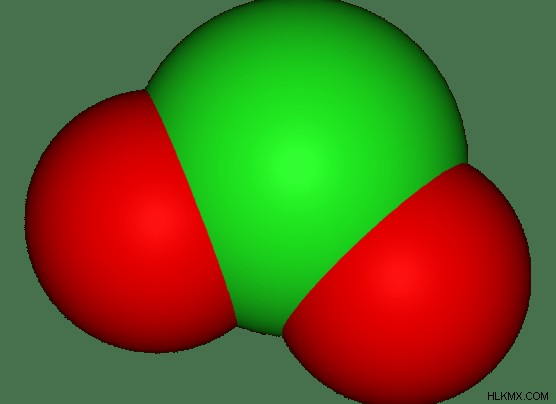
図 2:三原子イオン
多原子イオンの原子は互いに共有結合しています。シグマ結合だけでなく、パイ結合も存在する可能性があります。多原子イオンが配位錯体として形成されることもあります。ここでは、中心金属が中性荷電配位子に囲まれています。これらの配位子は、配位共有結合を介して中央の金属イオンに結合しています。次に、その錯体は錯イオンと見なされます。このイオンの電荷は、中央の金属イオンの電荷です。
それとは別に、何百もの多原子イオンがあります。それらは、イオンの全体的な電荷に応じて、陽イオンまたは陰イオンのいずれかになります。次の表にその一部を示します。
| 多原子陽イオン | 多原子陰イオン |
| NH4 | CO3 |
| H3 O | NO2 |
| [Co(H2 O)6 ] | CN |
| [Co(NH3 )6 ] | HSO4 |
| [Ni(H2 O)6 ] | ClO4 |
単原子イオンと多原子イオンの違い
定義
単原子イオン: 単原子イオンは、イオンごとに 1 つの原子を含むイオンです。
多原子イオン: 多原子イオンは、1 つのイオンが複数の原子から構成されるイオンです。
原子数
単原子イオン: 単原子イオンは、イオンごとに単一の原子で構成されています。
多原子イオン: 多原子イオンは、イオンごとに複数の原子で構成されています。
フォーメーション
単原子イオン: 単原子イオンは、原子の最外殻で電子を失うか獲得することによって形成されます。
多原子イオン: 多原子イオンは、共有結合または配位共有結合を介して複数の原子を結合することによって形成されます。
化学結合
単原子イオン: 単原子イオンには化学結合はありません。
多原子イオン: 多原子イオンには共有結合または配位共有結合があります。
例
単原子イオン: 単原子イオンの例には、Na、K、Cl などがあります。
多原子イオン: 多原子イオンの例には、NH4 が含まれます 、NO2 、NO3 など
結論
単原子イオンと多原子イオンは、それらのイオンに存在する原子の数に従って名前が付けられます。単原子イオンと多原子イオンの主な違いは、単原子イオンは単一の原子で構成されているのに対し、多原子イオンはイオンごとに 2 つ以上の原子で構成されていることです。







