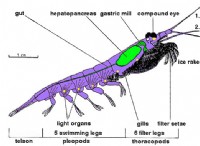
その理由は次のとおりです。
* 極性: ホスフィンにはPolar P-H結合がありますが、分子自体は非極性です 対称性四面体構造のため。これは、強い双極子モーメントがないことを意味します。
* 水素結合: ホスフィンは水分子と水素結合を形成することはできません。これは、酸素や窒素のような非常に電気陰性の原子に結合した必要な水素を欠いているためです。
したがって、水中のホスフィンの溶解度は、主に弱い van der waals力によって駆動されます。 、分子の疎水性性を克服するのに十分な強さではありません。
ホスフィンは水にわずかに溶けますが、依然として溶解性が低いと考えられています 水素結合を形成できる他のガスと比較。