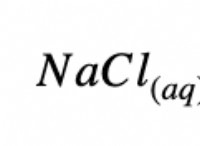これがそれがどのように機能するかの内訳です:
1。分子間力(IMFS):
* 強いIMFS: 強力なIMF(水素結合、双極子型双極子相互作用、ロンドン分散力など)を持つ物質は、互いに引き付けられる傾向があります。
* 弱いIMF: IMFが弱い物質は、魅力が弱いです。
2。溶解度:
* 溶解: 溶質が溶媒に溶解する場合、溶質分子と溶媒分子の間のIMFSは、純粋な溶質と溶媒内のIMFを克服するのに十分な強さでなければなりません。
3。 「好きなように」:
* 同様のIMF: 溶質と溶媒が同様のIMFを持っている場合、新しい相互作用は既存の相互作用を破るのに十分強くなり、溶質が溶解することができます。
* 異なるIMFS: 溶質と溶媒のIMFが大幅に異なる場合、新しい相互作用は弱くなり、溶質は容易に溶解しません。
例:
* 水(極性溶媒): 水には強い水素結合があります。それは、砂糖(水素結合もある)のような極性溶質と塩のようなイオン化合物(強い静電相互作用を持つ)を溶解します。
* オイル(非極性溶媒): オイルには、ロンドンの分散力が弱い。グリースやワックスのような非極性溶質を溶解します。これは、ロンドンの分散力が弱いです。
例外:
*「ように「溶解する」は便利なルールですが、完璧ではありません。異なるIMFを持つ物質が互いにある程度溶解できる例外があります。
* 極性 溶媒の場合、多くの場合、特定のタイプのIMFよりも溶解度のより信頼性の高い指標です。
要約:
「ように溶解する」という原則は、特定の溶媒に溶解する理由を理解するのに役立ちます。溶解を成功させるために、溶質と溶媒の間の分子間力を一致させることの重要性を強調しています。