コア コンセプト
このチュートリアルでは、正味のイオン方程式の書き方を学びます。 .さらに、溶液中のどのイオンが反応で活性で、どのイオンがスペクテーター イオンであるかを理解するのにどのように役立つかを学びます。
他の記事で取り上げるトピック
- 化学式のバランスをとる
- 一般的な多原子イオンのリスト
- 正式な請求
- 陽イオンと陰イオン
語彙
- 完全なイオン方程式: 分子をイオン形態に分離する分子方程式
- 正味のイオン方程式: 反応内で変化するイオンまたは分子を表す分子方程式
- 観客イオン: 変化を受けない反応中のイオン
- 水溶液: 溶媒が水である溶液
正味のイオン方程式とは?
正味のイオン方程式の定義は、反応に積極的に関与する分子またはイオン、または変化する分子またはイオンのみを表す方程式です。この方程式では、スペクテーター イオンは存在しません。
正味のイオン方程式を使用する理由
上記のように、正味のイオン方程式を使用して、反応で変化する分子を強調します。式に存在するのは活性分子だけなので、反応中の活性分子を簡単に確認できます!
正味のイオン方程式を書く
正味のイオン方程式を書くための最初のステップは、存在する化学方程式のバランスを取ることです。塩化ナトリウムと硝酸銀の反応を例に取りましょう。
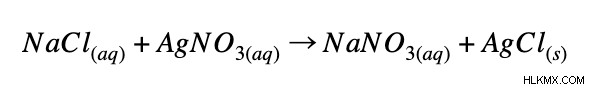
次に、化学方程式を完全なイオン方程式として書きます。これは、各分子をそのイオン形態に分離することを意味します。 (水性化合物のみに注意してください 化合物が固体または液体の場合、分子の形を維持する必要があります。上記の反応の完全なイオン方程式は次のようになります:
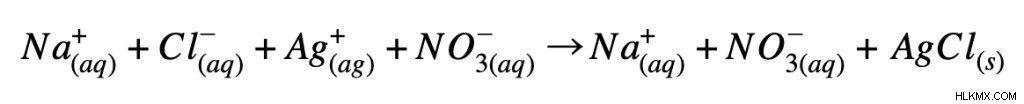
最後に、完全なイオン方程式を使用して正味のイオン方程式を書くことができます。まず、スペクテーター イオンを識別します。完全なイオン方程式を見ると、スペクテーター イオンは、反応物と生成物で同じ電荷と状態を持ちます。この反応では、ナトリウムイオンと硝酸イオンは変化しません。結果として、これらはスペクテーター イオンと見なされます。正味のイオン方程式を書くには、スペクテーター イオンを取り除く必要があります。
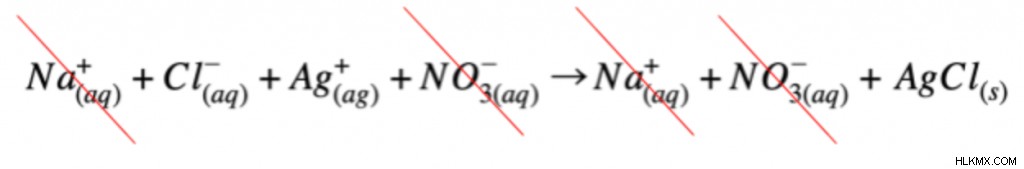
スペクテーター イオンを除去すると、正味のイオン方程式が残ります!
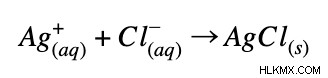
このプロセスを任意の反応に対して繰り返し、正味のイオン方程式を得ることができます。
正味のイオン方程式の例
他の化学反応の例と、それらの正味のイオン方程式がどのように見えるかを次に示します。
例 1:
完全なイオン方程式:
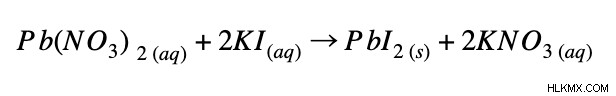
正味のイオン方程式:
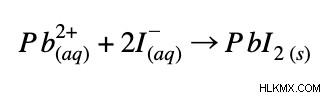
例 2:
完全なイオン方程式:
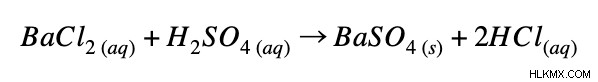
正味のイオン方程式:
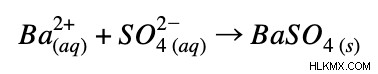
例 3:
完全なイオン方程式:
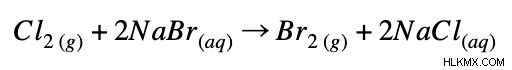
正味のイオン方程式:
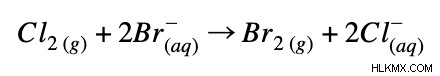
素晴らしい家庭実験
正味のイオン方程式をさらによく理解するために、この楽しく安全で簡単な家庭化学実験を行うことができます。そして、あなたはおそらくあなたが必要とするすべてを持っています!ビデオをご覧になり、YouTube チャンネルに登録してください。さらに多くのすばらしいビデオが公開されています!
ビデオの反応式は Mg + CO3 です -> MgCO3 (s)
さらに読む
- 酸化還元反応
- レドックス反応のバランスをとる
- アルミホイルから銅粉を作る