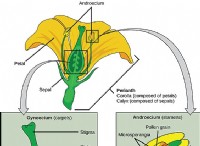
なぜ水素がアルカリ金属で配置されているのか:
* 電子構成: 水素は、アルカリ金属(Li、Na、Kなど)と同様に、最も外側のシェルに1つの電子を持っています。この単一の原子価は、アルカリ金属のように潜在的に反応性があります。
* イオン挙動: 水素はその電子を失い、アルカリ金属と同様に+1イオン(H +)を形成することができます。これは、HCl(塩酸)のようなイオン化合物を形成する傾向が明らかです。
* 反応性: アルカリの金属のように、特に非金属では水素は非常に反応性があります。
なぜ水素が一意であるのか:
* 小サイズ: 水素はアルカリ金属よりもかなり小さくなっています。このサイズの違いは、異なる特性につながります。
* 非金属挙動: 水素はイオン化合物を形成できますが、非金属のより典型的な共有結合も容易に形成します。
* ユニークな結合: 水素は、アルカリ金属とは異なり、珪藻分子(H2)を形成できます。
結論:
グループ1Aへの水素の配置は、単一の原子価電子のために便利です。ただし、そのサイズが小さい、共有結合を形成する傾向、および珪藻土の性質により、アルカリの金属とは異なります。 一部の定期的なテーブルは、グループ1Aの上に水素を配置し、その独自の特性を認識しています。