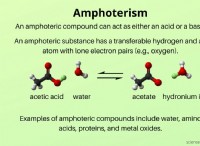
強い酸と弱酸を理解する
* 強酸: これらの酸は溶液中に完全にイオン化(分解)します。つまり、すべての水素イオン(H+)が放出されます。
* 弱酸: これらの酸は、溶液中に部分的にのみイオン化します。 それらは、酸性分子の一部がそのままのままで、水素イオンの一部のみが放出される平衡に達します。
答え:
強酸の1.0 m溶液のため H3O+の最高濃度は完全にイオン化し、酸のモルごとに1モルのH3O+イオンを生成するためです。
例:
* HCl(塩酸): 強酸。 1.0 m HCl溶液は、H3O+イオンの1.0 m濃度があります。
弱酸が濃度が低い理由:
弱酸の1.0 m溶液は、酸分子の一部のみがイオン化するため、H3O+イオンの濃度が低くなります。
要約:
同じ臼歯の場合、強酸溶液は、弱酸溶液よりも常に高濃度のヒドロニウムイオン(H3O+)を持ちます。