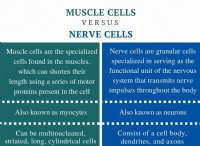
1。金属水酸化物の形成(最も一般的なケース):
* 反応: 多くの金属酸化物は水と反応して金属水酸化物を形成します。
* 例: 酸化ナトリウム(Na₂O)は水と反応して水酸化ナトリウム(NaOH)を形成します。
`` `
na₂o +h₂o→2naoh
`` `
* 一般化: グループ1および2つの金属(アルカリおよびアルカリの地球金属)は通常、水と反応して水酸化物を形成します。この反応はしばしば発熱性です(熱を放出します)。
2。金属酸化物の形成(あまり一般的ではない):
* 反応: 一部の金属酸化物、特に遷移金属の酸化物はすでに最高の酸化状態にあり、水酸化物を形成することはできません。
* 例: マンガン(VII)酸化物(Mn₂O₇)は水と反応して水酸化物を形成しません。すでに最高の酸化状態です。
3。反応なし:
* 反応: 一部の金属酸化物は比較的不活性であり、水と反応しません。
* 例: 酸化アルミニウム(al₂o₃)は非常に安定した酸化物であり、水とすぐに反応しません。
反応性に影響する要因:
* 周期表の金属の位置: グループ1および2の金属は、一般に、後のグループの金属よりも水よりも反応します。
* 金属の酸化状態: より高い酸化状態の金属は、水と反応する可能性が低くなります。
* 金属の電気陰性度: より多くの電気陰性の金属は、より安定した酸化物を形成する傾向があり、水と反応する可能性が低くなります。
重要な注意: 多くの金属酸化物は水と反応しますが、反応はその速度と強度が大幅に変化する可能性があります。一部の反応は非常に速くて発熱性ですが、他の反応は遅く、特定の条件が必要です。
例の反応:
* 酸化ナトリウム(Na₂O): 発熱反応、水酸化ナトリウム(NAOH)の形成
* 酸化カルシウム(CAO): 発熱反応、水酸化カルシウム(CA(OH)₂)
* 酸化アルミニウム(al₂o₃): 非常に遅い反応、水酸化アルミニウム(AL(OH)₃)の形成
* 鉄(iii)酸化物(Fe₂o₃): 水との有意な反応はありません。
これは一般的な概要であり、特定の金属酸化物の正確な挙動は、その特定の特性に基づいて調査する必要があります。