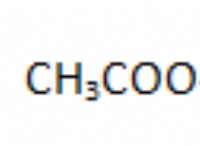* 反応メカニズム: 酸中のマグネシウムの溶解は、マグネシウム原子がマグネシウムイオンを形成するために電子(酸化)を失う化学反応です(mg 2+ )、水素イオン(H + )酸から水素ガスを形成するために酸ゲイン電子(還元)(H 2 )。
* 速度に影響する要因: この反応の速度は、いくつかの要因の影響を受けます。
* 酸の濃度: 酸の濃度が高いということは、H + の濃度が高いことを意味します イオン。これにより、マグネシウムとH + の間の衝突の可能性が高まります イオン、より速い反応速度につながります。
* マグネシウムの表面積: マグネシウムのより大きな表面積は、酸が反応するためにより多くの接触点を提供し、再び反応を加速します。
* 温度: 温度が高いほど、分子の運動エネルギーが増加し、より頻繁でエネルギー的な衝突につながり、反応速度が増加します。
* 不純物の存在: マグネシウムの表面の不純物は、触媒または阻害剤として作用し、反応速度に影響を与えます。
* 濃度の役割: 通常、酸の濃度が高いと反応速度が増加しますが、必ずしも単純な関係ではありません。濃縮酸は、マグネシウムの表面に保護層を形成し、反応を遅くすることがあります。このレイヤーは以下が原因である可能性があります。
* マグネシウム塩の形成: 濃縮硫酸の場合、硫酸マグネシウムの層(Mgso 4 )形成することができますが、これは溶けやすく、障壁として機能します。
* 不動態化: 濃縮酸酸は、マグネシウムの表面に薄い保護酸化物層が形成され、さらなる反応を防ぐ、パッシベーションを引き起こす可能性があります。
要約: マグネシウムが酸に溶解する速度は、複雑な要因の相互作用です。酸の濃度が高くなると、一般に反応が速くなりますが、これは必ずしもそうではありません。保護層または不動態化の形成は、実際に濃縮酸の反応を遅らせる可能性があります。