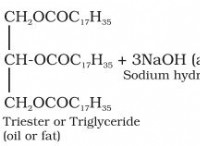* 極性: アセトンは極性溶媒です。つまり、分子内で電荷の分離があります。ベンゾ酸は、カルボン酸基を持っていますが、大きな非極性芳香族環もあります。アセトンの極カルボニル基は、ベンゾ酸の極カルボン酸基と相互作用することができますが、アセトンの非極性部分はベンゾ酸の芳香族環と相互作用できます。この相互作用の組み合わせにより、アセトン中のベンゾ酸の溶解が可能になります。
* 水素結合: アセトンは、ベンゾ酸のカルボン酸基と水素結合を形成できます。この相互作用は、アセトンへのベンゾ酸の溶解度をさらに高めます。
* 分散力: アセトン酸とベンゾ酸の両方の非極性部分は、ロンドンの分散力を介して相互作用し、全体的な溶解度に寄与する可能性があります。
要約すると、アセトンへのベンゾ酸の溶解度は、極性相互作用、水素結合、および分散力の組み合わせに起因し、ベンゾ酸の極性が比較的低いことを克服します。
ベンゾ酸は、非常に極性溶媒である水にあまり溶けないことに注意することが重要です。これは、ベンゾ酸の非極性芳香族リングが水分子によって容易に溶媒和されないためです。