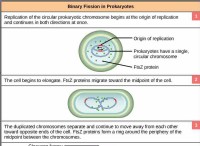
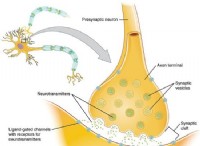
これが故障です:
* 高H+濃度: H+イオンの高濃度を持つ溶液は酸性 。これは、pH値が7未満であることを意味します。酸は酸味がある傾向があり、金属と反応して水素ガスを放出し、リトマスの紙を赤くすることができます。一般的な例には、レモン汁、酢、胃酸が含まれます。
* 低H+濃度: H+イオンの濃度が低い溶液はアルカリ または基本 。これは、pH値が7を超えることを意味します。塩基は苦い味がする傾向があり、滑りやすく、リトマスの紙を青くすることができます。例には、重曹、アンモニア、石鹸が含まれます。
* 中性H+濃度: h+とoh-イオンの等しい濃度の溶液は中性 。これは、pH値が7の値を持つことを意味します。純粋な水は中性溶液の良い例です。
環境への影響:
溶液のH+濃度(したがってpH)は、さまざまな自然プロセスや生態系に非常に重要です。例えば:
* 土壌pH: 土壌のpHは、植物の栄養の入手可能性に影響します。 酸性土壌で繁栄する植物もあれば、アルカリの土壌を好む植物もあります。
* 水ph: 水域のpHは、水生生物の生存と成長に影響を与えます。 たとえば、酸性雨は湖や川の酸性化につながり、魚の個体数を傷つける可能性があります。
* 生物学的プロセス: 生物の多くの生物学的反応は、pHの変化に敏感です。たとえば、化学反応を触媒する酵素は、その活性に最適なpH範囲を持っています。
要約:
H+イオンの濃度は、溶液の酸性度、中立性、またはアルカリ度を決定する上で極めて重要な役割を果たします。これは、その化学的特性と環境との相互作用に影響を与えます。