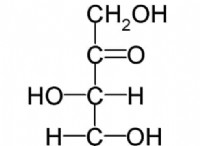
* 電気陰性の差: カリウム(K)の電気陰性度は0.82、塩素(Cl)の電気陰性度は3.16です。これらの値の違いは非常に大きい(2.34)。
* イオン結合形成: 大きな電気陰性度の違いは、塩素がカリウムよりも共有電子をはるかに強い引っ張っていることを示しています。これにより、塩素が本質的にカリウムから電子を「盗む」ことができ、負に帯電した塩化物イオン(Cl-)と正に帯電したカリウムイオン(K+)を形成します。これらの反対に帯電したイオンは、互いに引き付けられ、イオン結合を形成します。
キーポイント:
* 極性共有結合 2つの原子間に中程度の電気陰性の違いがある場合に発生し、電子の不均等な共有につながります。
* イオン結合 フォームは、大きな電気陰性の違いがある場合、電子の完全な移動とイオンの形成をもたらします。