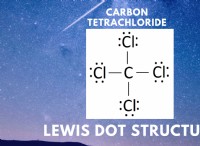
共有分子
* 融点の下部: 共有分子は一般に、イオン化合物よりもはるかに低い融点を持っています。
* 分子間力の弱い: 共有分子を一緒に保持する力は比較的弱いです。これらの力は、ロンドン分散力、双極子双極子相互作用、水素結合などの分子間力と呼ばれます。
* 例: 水(h₂o)、砂糖(c₁₂h₂₂o₁₁)、メタン(ch₄)
イオン化合物
* より高い融点: イオン化合物は、結晶格子にイオンを一緒に保持する強い静電力(イオン結合)のために、溶融点が有意に高い。
* 強力な静電力: イオン化合物の正と負のイオンは、強い静電力によって互いに引き付けられます。これらのアトラクションを克服し、クリスタル格子を破るには、多くのエネルギーが必要です。
* 例: 塩化ナトリウム(NaCl)、酸化カルシウム(CAO)、フッ化物マグネシウム(MGF₂)
キーポイント:
* 結合強度: 分子または化合物内の結合の強度は、その融点に直接影響します。強い結合は、より多くのエネルギーを壊す必要があり、より高い融点につながります。
* クリスタルラティス: イオン化合物は、通常の繰り返し結晶格子を形成し、高融点に寄与します。共有分子は通常、分子間力が弱く、秩序化の少ない構造を持っています。
例外:
これらの一般的な傾向には例外があります。ダイヤモンドやクォーツのような一部の共有分子は、構造内の強力なネットワーク共有結合のために非常に高い融点を持っています。
要約:
共有分子とイオン化合物の間の融点の重要な違いは、粒子を一緒に保持する力の強度に沸騰します。イオン化合物には強い静電魅力(イオン結合)がありますが、共有分子は分子間力が弱いです。