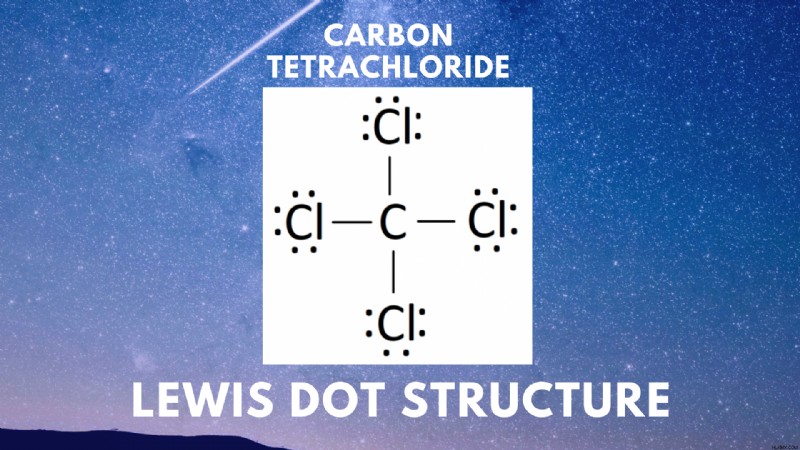
CCL4 ルイス構造 共有結合した化合物の電子配置を表す図です。ルイス構造は、特定の化合物の原子構造と電子の分布を視覚化することを目的としています。
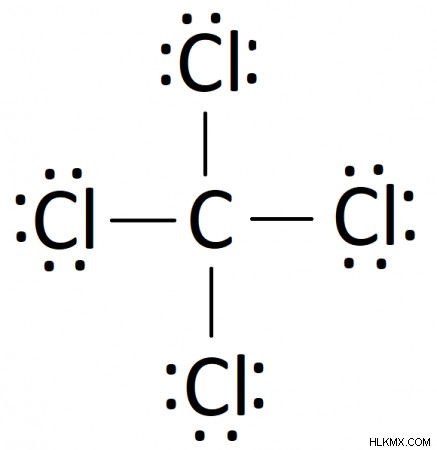
四塩化炭素 (CCl4 ) は、四面体構造の 4 つの塩素原子に囲まれた中心炭素で構成される共有結合化合物です。四塩化炭素のルイス線図は次のとおりです。
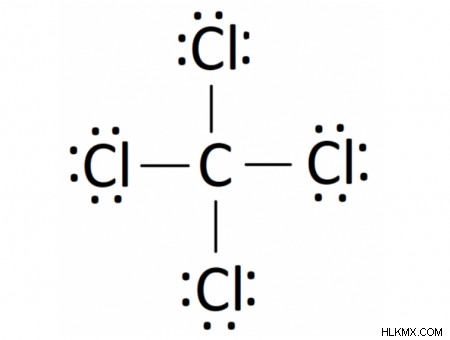
通常の炭素原子は、その外殻に 4 つの孤立電子を持っています。塩素は 7 個の電子を持っているため、その外殻を完全に満たすには 1 個の電子が不足しています。したがって、炭素原子はその 4 つの外側の電子のそれぞれを単一の塩素原子と共有し、単一の炭素原子と 4 つの塩素原子に電子の完全な外殻を与えます。得られた化合物では、各元素は外殻に 8 個の電子を持つことで安定した電子配置を実現しています。
ルイス構造:基本
ルイス構造は、1916 年にアメリカの化学者 G.N ルイスによって最初に導入されました。それ以来、化学結合を理解するための簡単な方法として、高校や大学レベルの化学コースで広く使われるようになりました。
ルイス構造は、化合物の原子構造と電子構造を表すことを意図しています。ルイス構造では、化合物の各元素はその化学記号で表されます。つまり、H は水素、C は炭素、O は酸素などです。元素の電子殻の構成は、化学記号を囲む点のパターンで表されます。共有電子対は、結合した 2 つの要素を結ぶ 1 本の線として表されます。孤立電子対 (化学結合に関与しない電子) は、化学記号の横にある一対の孤立点として表されます。
記号の周りに何個のドットがあるかは、要素の価数によって決まります —その外殻の電子の数。たとえば、酸素は外殻に 6 個の電子を持っているため、6 の価数を持っています。ほとんどの元素は、外殻を完全に満たそうとし、原子価が 8 になるまで他の元素と結合します。これは、8 個の電子の完全な外殻に相当します。化合物中の元素が 8 個の電子の完全な原子価殻を持つように配列する傾向は、オクテット規則と呼ばれます .オクテット規則の唯一の例外は水素です。水素は、電子が 2 つしかない完全な外殻を持っているため、電子が 2 つになるまで結合を形成します。
たとえば、水 (H2 O) は、1 つの酸素原子と 2 つの水素原子で構成される化合物です。酸素は6つの価電子を持ち、水素は1つの価電子を持っています。水は、酸素原子が外殻にある 2 つの孤立電子を水素原子の 1 つの孤立電子と共有することによって形成されます。したがって、水のルイス構造は次のように表すことができます。

水素原子と酸素原子を結ぶ 2 本の実線は、それらの間で共有される電子対を表し、2 対の孤立点は酸素原子の孤立電子対を表します。水素の価数は1、酸素の価数は6なので、足すと1(2)+1(6)=8となります。したがって、この図には合計 8 個の電子があります。
ルイス構造を作るためのルール
ルイス構造は、化合物の成分の構成を理解するための非常に便利なツールです。次の手順に従って、化合物のルイス図を作成できます:
ステップ 1. 図中の価電子の総数を特定します。
ルイス図の価電子の総数は、化合物を構成する個々の元素の価電子数の合計に等しくなります。 CCl4 の使用 例として、この図の電子の総数は、炭素の原子価と塩素の各原子の原子価の合計に等しくなります。炭素の原子価は 4 で、4 つの塩素原子はそれぞれ原子価が 7 です。したがって、CCl4 の図の電子の総数は
1(4)+4(7) =32 個の電子 .
ステップ 2. 化合物の原子構造の骨格をスケッチします。
次は、化合物の原子組織を把握することです。化合物が 2 原子 (2 つの原子のみで構成されている) の場合、これは簡単です。原子構造は、直線で隣り合って位置する 2 つの原子になります。 3 つ以上の原子を持つ化合物では、事態はもう少し複雑になります。 3 つ以上の原子を持つほとんどの化合物では、複数の原子と結合を共有する中心原子 (または複数の原子) が存在する傾向があります。中心原子は、化合物の電気陰性度が最も低い要素になる傾向があります。
私たちの場合、炭素は塩素よりも電気陰性度が低いため、炭素が中心原子です。次のように、4 つの塩素原子に囲まれた中央の炭素原子で図をスケッチできます。
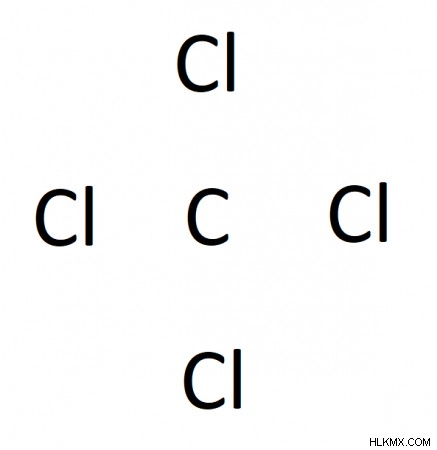
ステップ 3. 結合した各原子対の間に単結合を配置します。
今度は、図を電子で埋めます。 1 本の線は 1 つの共有電子対を表すことに注意してください。原子は電子を共有することによって共有結合化合物を形成するため、すべての原子は少なくとも 1 対の電子を別の原子と共有する必要があります。前の図の各原子に単結合を追加すると、次のようになります。
各ラインは 2 つの電子をカウントするため、8 つの電子を使用しました。つまり、まだ 32−8=24 個の電子があることを意味します 図に配置するために残しました。
ステップ 4. 外側の原子から始めて、各外側の原子がオクテット規則を満たすまで電子対を埋めます (2 になる水素を除く)。
原子は外殻を電子で満たそうとするため、他の結合を形成する前にそうしようとします。すべての末端原子が 8 個の原子に囲まれるまで、図を電子対 (ドット) で埋めます。共有原子ペアは、各原子の価電子の総数にカウントされることに注意してください。図に記入すると、次のようになります。
12 個の電子対を配置したので、24−12(2) =0 個の電子 置いておきます。すべて配置しました!
ステップ 5. 電子対が残っている場合は、いっぱいになるまで中心原子の隣に置きます
末端の原子が完全なオクテットになると、余分な電子はどこにも行き場がなくなり、中心の原子に戻ります。中心原子が完全なオクテットになるまで、残りの電子対を中心原子の周りに配置します。これらのペアは 孤立ペアとして存在します
私たちの場合、電子は残っておらず、ダイアグラム内のすべての原子がオクテット規則を満たしています。
ステップ 6. 中心原子がまだ完全な外殻を持っていない場合は、既存の電子対を一緒に移動して double を形成します。 または トリプル
すべての末端原子が完全な殻を持っている場合、配置する予備の電子対はこれ以上なく、中心原子 まだ 完全な外殻を持っていないため、原子は少し創造的になる必要があります。末端原子からの既存の電子対が移動し、電子の共有対を結合して二重結合または三重結合を形成します。二重結合は、本質的に末端原子と中心原子が 4 つの電子 (三重結合の場合は 6 つ) を共有しています。二重結合は、二重線 (=) または三重線 (≡) で表されます。
これらの手順に従って、多数の共有結合化合物のルイス図を作成できます。私たちの場合、CCl4 の最終的なルイス図 です:
ルイス図の限界
ルイス図は有用であり、主族元素から構成される化合物の電子配置を決定するのに十分正確ですが、いくつかの欠点があります。すべての化合物が、上記の結合規則に厳密に従っているわけではありません。どんな規則にも言えることですが、例外があります。たとえば、遷移金属は多くの場合、オクテット規則に従わず、代わりに 12 個の電子で外殻を満たします。一部の化合物については、1 つの適切な図がないため、それらの化合物の電子配置は、複数のルイス図のハイブリッドとして記述されます。これらは 共鳴構造と呼ばれます .
また、ルイス図は、化合物の極性と分子間結合挙動を説明するために重要な、原子の 3 次元幾何学的配向に関する情報をあまり提供しません。 VESPR 理論は、分子の 3 次元形状と、その形状が電子対の静電反発からどのように生じるかを説明する化学モデリング手法です。電子は互いに反発するため、分子は電子対間の反発を最小限に抑える形状を取る傾向があります。この情報を使用して、特定の化合物の可能性のある幾何学的構造を予測できます。
さらに、ルイス図は理由を説明しません または方法 電子は結合を形成します。これは、分子軌道理論 (MO 理論) に残されている問題です。これは、電子の波のような特性によって電子軌道がどのように結合するかを説明する数学的手法です。
要約すると、ルイス図は、共有結合した化合物の電子配置を説明する便利で簡単な方法です。ルイス図は、電子が化合物内でどのように分布しているかを示し、その分布を予測するために使用できます。ルイス図は簡単に作成でき、一連の単純なルールに従って作成できます。周期 2–7 の主族元素から形成されたほとんどの化合物のルイス構造は、上記のルールセットに従って構築できます。