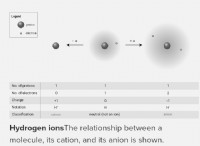
酸化反応における酸性溶液と基本溶液:
溶液の酸性度または塩基性は、影響を与えることにより、酸化還元反応に大きな影響を与える可能性があります。
1。 酸化された還元種の安定性:
* 酸性条件: 酸化されたの安定性を支持します 種、多くの場合、電荷のバランスをとるために使用できる陽子(H+)を提供することにより。
* 基本条件: 減少の安定性を支持します 種、水酸化物イオン(OH-)は酸化種と反応して、安定した還元生成物を形成することができます。
2。 酸化および還元剤の可用性:
* 酸性条件: 多くの場合、 h+のような強力な酸化剤のより大きなプールを提供します それ自体、それは電子を容易に得ることができます。
* 基本条件: ああ - のような強力な還元剤のより大きなプールを提供する 、電子を容易に寄付できます。
3。 反応のメカニズム:
* 酸性条件: 多くの場合、プロトン移動が関与します メカニズムのステップ、さまざまな中間体と製品につながります。
* 基本条件: 多くの場合、ヒドロキシドイオンが関与します さまざまな中間体と製品につながる手順を転送します。
例:
* 酸性溶液中の鉄(Fe)の酸化: Fe(S) + 2H +→Fe2 + + H2(g)
* 基本溶液中の鉄(Fe)の酸化: 2fe(s) + 3h2o(l) + 3/2o2(g)→2fe(oh)3(s)
溶液が酸性反応のために酸性であるか基本的かどうかを判断する方法:
* ph: 7未満のpHは酸性溶液を示し、7を超えるpHは基本的な溶液を示します。
* 強酸/塩基の存在: HCL、H2SO4、HNO3、またはNaOH、KOHのような強い塩基などの強酸の存在は、それぞれ酸性または塩基性の溶液を示しています。
* バッファ溶液の使用: バッファーを使用して特定のpHを維持することができます。これは、酸化還元反応を制御するために重要です。
要約:
溶液の酸性度または塩基性は、反応物の安定性、酸化および還元剤の利用可能性、および反応メカニズムに影響を与えることにより、酸化還元反応の結果を大幅に変える可能性があります。 したがって、酸化還元反応を分析および予測する際には、溶液のpHを考慮することが重要です。