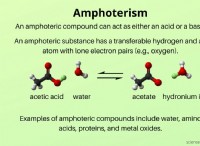
* 酸素(O) :酸素には6つの価電子があり、オクテットを完成させるためにさらに2つ必要です。水分子(H₂O)に見られるように、2つの共有結合を形成します。
* 炭素(c) :炭素には4つの価電子があり、オクテットを完成させるためにさらに4つ必要です。ただし、2つの二重結合または1つのトリプルボンドと1つの結合を形成できます。これは、二酸化炭素(CO₂)やアセチレン(C₂H₂)などの分子に見られます。
* 硫黄 :硫黄には6つの価電子があり、多くの場合、2つの共有結合を形成します。これは、硫化水素(H₂S)で見られます。
* 窒素(n) :窒素は通常、3つの共有結合を形成しますが(アンモニア、NH₃のように)、ヒドラジン(n₂H₄)などの場合、場合によっては2つの共有結合を形成することもあります。
重要な考慮事項:
* 価電子: 原子の価電子の数は、形成できる結合の数を決定します。
* オクテットルール: 原子は通常、8つの原子価電子を望んでいます(水素とヘリウムを除き、2が必要です)。
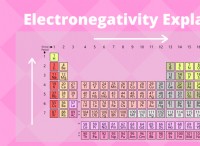
* 電気陰性度: 関与する原子の電気陰性度は、形成された結合の種類に影響を与える可能性があります(単一、二重、トリプル)。
原子形成の特定の数の結合数は、その一部の分子によって異なる場合があることに注意することが重要です。