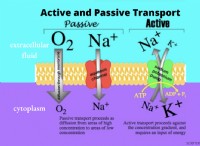
その理由は次のとおりです。
* 亜鉛はニッケルよりも反応的です。 これは、亜鉛が電子を失い、陽性イオンを形成する傾向が強いことを意味します。
* 単一変位反応: このタイプの反応では、より反応性のある要素は、化合物からより反応性の低い要素を変位させます。
反応:
Zn(s) +nicl₂(aq)→zncl₂(aq) + ni(s)
説明:
*亜鉛(Zn)は、ニッケル(NI)を塩化ニッケル(NICL)から置き換えます。
*亜鉛は、溶液中に塩化亜鉛(Zncl₂)を形成します。
*ニッケル(NI)は固体として堆積します。
観測:
*亜鉛金属の表面に灰色の固体ニッケルが形成されるのを観察します。
*塩化ニッケルが消費され、塩化亜鉛が生成されると、溶液はわずかに曇りになります。
注: 溶液が加熱されると、反応はより容易に進行します。