ゲイ リュサックの法則とは?
ゲイ・リュサックの法則は、質量と体積が一定に保たれている場合、気体の圧力が温度によって直接変化することを示す気体の法則です。温度が上昇すると、圧力も上昇します。概念は以下の図に示されています。
この現象は、温度が上昇すると、気体分子の運動エネルギーが増加するために発生します。エネルギーの増加は、分子がより大きな力で容器の壁に衝突することを意味し、圧力が高くなります。
ゲイ・リュサックの法則は、アモントンの法則と呼ばれることもあります。アモントンは、測定された圧力が現在の温度の読み取り値である温度計を作成することによって、同じ法則を証明しました。ゲイ・リュサックは法則をより正確に証明したので、彼の名前で呼ばれることが多くなりました。
ゲイ リュサックの法則
ゲイ・リュサックの法則は、体積と質量/モルが一定に保たれている場合、圧力と温度が一定に関連する式を示します。つまり:
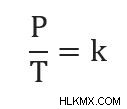
また、2 つの異なる点で圧力と温度を関連付けることもできます。これは、両方とも同じ定数値に等しいためです。つまり:
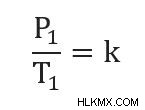
そして
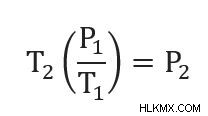
したがって、
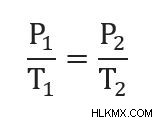
この数式は、さまざまな形式で記述されていることがあります。たとえば、変数を並べ替えて取得できます
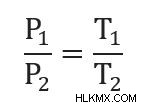
これらの方程式の k は、理想気体の法則を再構成することによっても解くことができます。
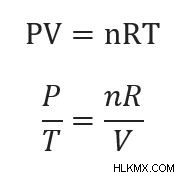
体積 (V) とモル数 (n) を一定にしています。 R は常に定数です。したがって、一番下の式の右辺全体は定数です。
ゲイ リュサックの法則の実例
冬に気温が下がると、車のタイヤの空気圧が低下しているというアラートが表示されることがあります。この現象は、ゲイ リュサックの法則に見られる関係のために発生します。温度が下がると、正比例してタイヤの圧力が下がります。ただし、内部のガスの総体積と総質量は同じままです。 (温度変化が大きいとタイヤの体積は変化しますが、温度変化が小さい場合は比較的同じままです)
プロパンタンクも同じです。タンクは、外気温に応じて、より低いまたはより高い圧力を読み取る場合があります (タンクを使用してグリルしない限り!)。温度が上昇するにつれて、タンクの圧力計は高くなります。
気温が下がって圧力が下がっていく様子をビジュアルで確認したり、崩壊缶の実験をしてみたり!この実験は、ゲイ リュサックの法則を完全に表したものではありませんが、温度による圧力変化の良い例です。ゲイ リュサックの実験では、一定の容積を持つ堅い容器を使用しました。
ゲイ リュサックの法則の例の問題
問題:20℃で 2.00 気圧のエアゾール容器を廃棄しようとしています。容器を廃棄すると、110℃の温度に上昇する場合があります。この温度での圧力は?
解決策:
まず、持っている変数を特定する必要があります。 P1 =2.00 atm、T1 =20C または 293K、T2 =110C または 383K であることがわかっています。 P2 を解こうとしています .
ゲイ・リュサックの法則の方程式は次のとおりです。
P2 を解くために再配置できます .
次に、値をプラグインして解決します。
問題:あなたの車のタイヤは 2.24 atm で、外気温は華氏 80 度です。外気温が0度の時のタイヤの空気圧は? (パンクしてもタイヤの体積は変わらないと仮定)
有効なソリューション:
タイヤを見ているので、モル数と体積は一定です。これは、ゲイ-ルッカスの法則を使用できることを意味します。
私たちの P1 =2.24 気圧と T1 =80F または 300K。 T2 =0F または 255 K もわかっています。P2 について解く必要があります。 .
上記の問題から、再構成された方程式が得られます。 (方程式の並べ替え方を覚えていない場合は、前の問題で解決します)
次に、わかっている数字を入力して、答えを計算します。
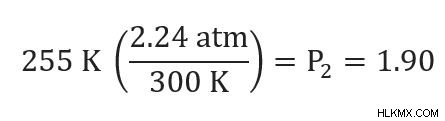
新しいタイヤの空気圧は 1.90 気圧です。以前のタイヤの圧力 2.24 気圧よりも大幅に低くなりました!
ゲイ リュサックとは?
ジョセフ ルイ ゲイ リュサックは、1778 年から 1850 年まで生きたフランスの化学者でした。彼は、1800 年代初頭に有名なゲイ リュサックの法則を発見し、共有しました。上記の法則以外にも、彼は多くの分析化学技術を開発し、ホウ素を発見しました。彼は、カルシウムやカリウムを含む他のいくつかの元素を発見したハンフリー・デービーとライバル関係にありました.
楽しい事実!高高度で地球の磁場を測定する試みで、ゲイ・リュサックは約 50 年間、最も高い気球飛行の世界記録を保持していました。彼は約 7,000 メートルまたは 23,000 フィートの高さに達しました。
その他のガス法
- 理想気体の法則
- ボイルの法則
- シャルルの法則
- アボガドロの法則
- ダルトンの法則
- 混合ガス法