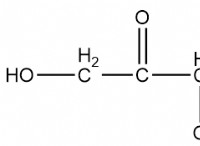
可溶性水酸化物を形成する金属
* グループ1アルカリ金属(Li、Na、K、Rb、CS): これらの金属は、非常に可溶性の水酸化物を形成します。これは、強い電気陽性の性質によるものです。つまり、陽イオンを形成するために電子を容易に失います(正のイオン)。得られたカチオンの電荷密度は高く、水酸化物イオン(OH-)に強く引き付けられ、可溶性イオン化合物が形成されます。
* グループ2アルカリ地球金属(BE、MG、CA、SR、BA): グループ1の水酸化物よりも溶解性が低いですが、アルカリ地球水酸化物は依然として溶けやすいです。この溶解度は、陽イオンのサイズが増加しているため、グループの低下を減らし、電荷密度を低下させ、水酸化物イオンの誘引を弱めます。
一部の金属が不溶性水酸化物を形成する理由
* 遷移金属: 多くの遷移金属は不溶性の水酸化物を形成します。これは、カチオンがさまざまな酸化状態(電荷)を持ち、水酸化物イオンとのより複雑な結合相互作用につながるためです。これらの相互作用により、しばしば固体、不溶性の沈殿物が形成されます。
* 他の金属: アルミニウム、鉛、鉄などの金属は、通常、不溶性の水酸化物を形成します。不溶性に影響を与える要因には、陽イオンの高電荷密度と強力な金属加熱結合の形成が含まれます。
溶解度に影響する重要な要因
* 電気促進性: 高度な電気依存症の金属は、水酸化物イオンとの強い結合を形成し、可溶性水酸化物をもたらします。
* 電荷密度: 金属陽イオンのより高い電荷密度は、水酸化物イオンのより強い魅力につながり、溶解度を促進します。
* 陽イオンのサイズ: 大きな陽イオンは電荷密度が低く、水酸化物イオンへの誘引を弱め、溶解度の低下をします。
* 複合イオン形成: 複合イオン(金属イオンと他のリガンドの組み合わせ)の形成は、溶解度に影響を与える可能性があります。いくつかの複雑なイオンは可溶性ですが、他のイオンは溶けません。
重要な注意: 金属水酸化物の溶解度は、温度、pH、他のイオンの存在などの特定の条件によって異なります。