1。 結合極性
* 電気陰性度: 結合極性を理解するための鍵は、電気陰性度です。 電気陰性度は、化学結合内で電子を引き付ける原子の能力です。 より高い電気陰性度は、共有電子のより強い引っ張りを意味します。
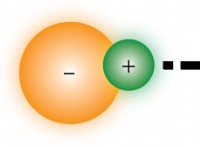
* 極性共有結合: 異なる電気性結合を持つ2つの原子の場合、それらは極性共有結合を形成します。より電気陰性の原子は部分的な負電荷(Δ-)を持ち、電気陰性原子が少ない場合は部分的な正電荷(Δ+)になります。
* 非極性共有結合: 同様の電気陰性度を持つ2つの原子が結合すると、電子はかなり均等に共有します。 これにより、非極性共有結合が生じます。
2。分子形状
* 対称性の重要: 分子に極性結合がある場合でも、その全体的な極性はその形状に依存します。
* 非極性分子: 極結合が中心原子の周りに対称的に配置されている場合、それらの双極子はキャンセルし、非極性分子になります。 誰もが平等な力で引っ張る綱引きを考えてください - ネットの動きはありません。
* 極分子: 極結合が非対称に配置されている場合、双極子はキャンセルせず、極性分子になります。 片側が強くなっている綱引きを想像してみてください。その方向にネットの動きがあります。
3。イオン化合物
* 電子の伝達: イオン化合物は、2つの原子(通常は金属と非金属)間で電気陰性度に有意な差がある場合に形成されます。より電気陰性の原子は、より少ない電気陰性原子から完全に電子を取り、イオン(荷電粒子)を形成します。
* 静電引力: その後、反対に帯電したイオンは静電誘引によって一緒に保持され、結晶格子を形成します。
例
* 水(h₂o): 酸素は水素よりも電気陰性であり、極性結合を生成します。 分子は曲がっているので、双極子はキャンセルせず、水分極を作ります。
* 二酸化炭素(CO₂): 酸素は炭素よりも電気陰性であり、極結合を生成します。 ただし、分子は線形で対称的であるため、双極子はキャンセルして二酸化炭素を非極性にします。
* 塩化ナトリウム(NaCl): ナトリウム(Na)は金属であり、塩素(Cl)は非金属です。大きな電気陰性の違いがあり、電子の伝達につながります。 ナトリウムは電子を失い、Na⁺になり、塩素は電子を獲得してCl⁻になります。これらのイオンはイオン化合物を形成します。
覚えておくべきキーポイント
* 電気陰性度は基礎です: 結合のタイプを決定します。
* 分子ジオメトリが重要な役割を果たします: 対称性または非対称性は、全体的な極性を決定します。
* イオン化合物には、電子の完全な伝達が含まれ、荷電イオンが形成されます。
より具体的な例を希望するか、それ以上の質問があるかどうかを教えてください。