分子間力とは?
分子間力は、永久的または一時的に (一時的に) 帯電した化学種間の静電相互作用です。それらには、ファン デル ワールス力 (相互作用)、イオン-双極子および双極子-双極子力が含まれます。
この用語は通常、分子とイオンを凝縮相 (液体と固体) に保持する引力的相互作用のみを指すために使用されます。これらの力は、融点、沸点、表面張力など、物質や混合物のバルク物理特性の多くを支配します。
関連トピック
- 陽イオンと陰イオン
- イオン結合と共有結合
- 双極子モーメントとは
- 共同プロパティ
- 均質混合物と異種混合物
イオン結合の基礎
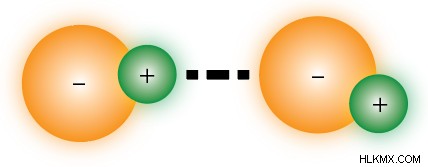
イオン結合としても知られるイオン間力は、最も理解しやすいものです。これらの力は、反対の電荷を持つ 2 つのイオン間の静電引力から生じます。 技術的には分子間力とは見なされていません が、真の IMF (分子間力) を理解するための出発点として役立ちます。イオン結合は一般に、以下で説明する力よりも強力です。これが、ほとんどの純粋な塩が非常に高温でない限り固体である理由です.
この完璧な例は、摂氏 800 度の融点を持つ食卓塩 NaCl です。
分子間力の種類
ファンデルワールス軍
ファン デル ワールス力、別名ファン デル ワールス相互作用 最も弱い分子間力であり、弱い双極子間力とより強いロンドン分散力で構成されています。それらは、オランダの化学者ヨハネス・ファン・デル・ワールス (1837-1923) にちなんで名付けられました。非理想気体のファン デル ワールス方程式では、これらの分子間力が考慮されます。これらの力は、物質が特定の温度で固体、液体、気体のいずれであるかを決定します。
以下で説明するファンデルワールス力には、ロンドン分散力と双極子間力 (相互作用) の 2 種類があります。
イオン双極子力
イオン双極子力は、荷電種と極性分子との相互作用から生じます。それらはイオン結合に非常に似ていますが、極性分子は部分しか持たないため、弱くなる傾向があります。 静電気引力が少なくなります。これらの力により、極性溶媒は、非極性溶媒と比較して、NaCl などのイオン性固体をよりよく溶解できます。
イオン誘起双極子相互作用
イオン双極子力に密接に関係しているのは、イオン誘起双極子力です。この場合、分子に永久双極子はありません。代わりに、イオンは、非極性分子の電子を引き付けたり反発したりすることによって、非極性分子から一時的な双極子を生成します。次に、イオンと一時的な部分電荷の間に引力が形成されます。
双極子間力
双極子間力は、ファン デル ワールス力の一種です . 2 つの極性分子が相互作用すると、反対の部分電荷がイオン結合と同様に引き合いますが、電荷の大きさが小さいため、一般的に弱くなります。これらの双極子間力により、極性化合物は非極性化合物よりも融点と沸点が高くなる傾向があります。
水素結合
水素結合は、特殊なタイプの双極子間相互作用です。これは、問題の分子が水素原子に直接結合した電気陰性度の高い原子を持っている場合にのみ発生し、異常に極端な双極子を引き起こします。ほとんどの場合、これらの電気陰性度の高い原子は、窒素、酸素、およびフッ素のみに限定されます。
水素結合には、「ドナー」分子と「アクセプター」分子が含まれます。ドナーは結合に水素原子を提供し、アクセプターは電気陰性原子を提供します。下の画像では、上の 2 つの水分子は両方ともドナーとして機能し、下の分子はアクセプターとして機能しています。一部の分子はアクセプターとしてのみ機能します。
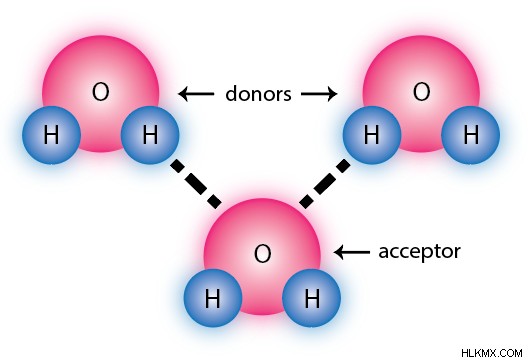
水素結合にも方向性があります。結合は、関与する 3 つの原子がほぼ直線 (180 度の角度) にある場合にのみ、水素結合としての資格を得ることができます。これは、方向性のない通常の双極子間結合とは一線を画します。
ロンドン分散部隊 (LDF)
多くの場合、LDF と略されるロンドン分散力は、2 つの過渡双極子間の引力です。 .また、ファン デル ワールス軍の一種でもあります .これは直感的ではないように思えるかもしれませんが、2 つの非極性分子が互いに近くにある場合、それらの電子雲の振動により、両方が何らかの極性を獲得する可能性があります。結果として生じる過渡電荷間の引力を、ロンドン分散力と呼びます。
個々の基準では、LDF は一般に分子間力の中で最も弱いものです。ただし、多くの LDF 相互作用の累積効果により、全体的な魅力が非常に高くなる可能性があります。相互作用の数は、分子の表面接触面積と密接に関連しているため、大きな非極性分子は LDF からかなりの量の引力を受ける可能性がありますが、小さくてコンパクトな分子はほとんど感じない可能性があります。類似した形状の 2 つの分子 (たとえば、2 つの希ガス) を比較すると、モル質量が大きい方が LDF が強くなります。
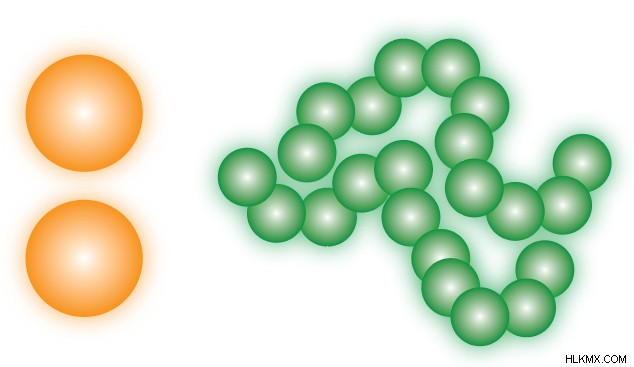
ロンドン分散力は非極性分子に存在する唯一の IMF ですが、他のすべてのタイプの物質にも存在することに注意することが重要です。 .極性分子も LDF に関与しますが、これらの場合、他の IMF ほど重要ではないため、言及されないことがあります。
分子間力:最強から最弱へ
<オール>例:IMF の強さのランキング
<強い>1.次の混合物を最も強い IMF から最も弱い IMF にランク付けしてください:
- エタノールとアンモニア
- 水と塩化カリウム
- オクタンとメタン
- クロロホルムとアセトン
2. 次の純物質を沸点の高い順にランク付けしてください:
- プロパン
- 水
- ジクロロメタン
分子間力:ソリューション:
<強い>1.化合物の各ペア間の最も強い相互作用を探します。
<オール>これら 2 つは極性分子とイオン性化合物であるため、それらの間にはイオン双極子力が存在します。これらは、一般的に最も強い分子間力です。
これらは両方とも極性分子であるため、双極子間力を持ちますが、さらに重要なのは、通常の双極子間相互作用よりも強い水素結合が可能です。
これらは両方とも、水素結合に関与できない極性分子です。双極子間相互作用があります。
注: すべての物質には、他の IMF に加えてロンドン分散力があることを忘れないでください!
<強い>2.沸点は IMF 強度に関連していることを思い出してください。 IMF が強いほど、沸点が高くなります。
<オール>






