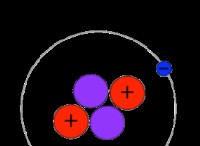
* 水は極性分子です: 水素原子に部分的な正電荷と酸素原子に部分的な負電荷があります。この極性により、水分子は他の極性分子と水素結合を形成できます。
* ベンゼンは非極性分子です: これは、炭素と水素の原子のみを備えた対称リング構造です。電子は均等に分布しているため、全体的な電荷分離はありません。
なぜベンゼンが水で撃退されるのか:
* "like like dislols like": 極性分子は他の極性分子によく溶解し、非極性分子は他の非極性分子によく溶解します。
* 水素結合: 水分子は他の水分子と強い水素結合を形成できますが、ベンゼンと同様の結合を形成することはできません。
* 疎水性効果: ベンゼンの極性の欠如により、極水分子によって極性が撃退されます。この反発は、疎水性効果として知られています。
他の分子:
* C2H5OH(エタノール)、CH3CH2CH2OH(プロパノール)、およびCH3-O-CH3(ジメチルエーテル): これらの分子にはすべて、酸素と水素原子が含まれており、水との水素結合に関与します。これにより、ベンゼンよりも水に溶けやすくなります。
要約: ベンゼンの非極性性は、極水分子と互換性があり、強い反発につながります。