1。強力な水素フルオリン結合:
*水素とフッ素の結合は非常に強いです。これは、フッ素が最も電気陰性の要素であり、水素とフッ素の間の電気陰性度に有意な違いをもたらすためです。
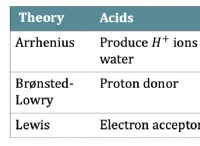
*この強い結合により、HFはプロトン(H+)を寄付し、酸として機能することが困難です。
2。水素結合:
* HF分子は、溶液中に互いに強い水素結合を形成します。この水素結合はさらにHF分子を安定させ、H+をイオン化して放出する可能性が低くなります。
3。フッ素のサイズが小さい:
*フッ素原子のサイズが小さいため、水素原子との強い相互作用が可能になり、強い結合とイオン化の阻害に寄与します。
4。非局在化の欠如:
*他のハロゲン化物イオン(Cl-、Br-、I-)とは異なり、フッ化物イオン(F-)には有意な電子非局在化はありません。この非局在化の欠如により、安定性が低くなり、形成される可能性が低くなります。
対照的に、他のヒドロハル酸(HCl、HBR、HI)は強酸です:
* 弱いH-X結合: 水素と塩素、臭素、ヨウ素の結合は、H-F結合よりも弱いです。
* ハロゲンのサイズが大きい: 塩素、臭素、ヨウ素のサイズが大きいと、水素原子との相互作用が弱くなり、イオン化が促進されます。
* 電子の非局在: ハロゲン化物イオン(Cl-、Br-、I-)はより大きな電子非局在化を行い、それらをより安定させます。
したがって、強力なH-F結合、水素結合、フッ素のサイズが小さいこと、およびF-の電子非局在化の欠如は、HFを他のヒドロハル酸と比較して弱酸になります。