コア コンセプト
この記事では、化学反応のエンタルピーを計算する最も重要な方法について学びます。読んだ後、さまざまな一般的な状況で反応のエンタルピーを計算できるようになります。
取り上げるトピック 他の記事
- 結合エンタルピー
- 燃焼エンタルピー
- 熱力学の法則
- ギブスの自由エネルギー
- 平衡定数
エンタルピーとは?
化学者と物理学者は、エンタルピーを、一定の圧力下でプロセスによって放出される熱と定義しています。エンタルピーは「状態変数」です。つまり、システムのエンタルピーの変化は、2 つの状態の間の特定の経路ではなく、システムの初期状態と最終状態にのみ依存します。
化学では、化学反応の熱力学を理解するときにエンタルピーが最も多く使用されます。特に、反応のエンタルピー変化の符号は重要な情報をもたらします。
たとえば、反応のエンタルピーの変化に正の符号がある場合、化学者はその反応を「吸熱反応」と呼びます。吸熱反応には、反応物が環境から熱を吸収することが含まれます。一般に、吸熱反応は熱力学的に有利ではないか、高温でのみ有利です。
対照的に、反応のエンタルピーの変化が負の符号を持っている場合、化学者はその反応を「発熱」と呼びます。代わりに、発熱反応には、環境に熱を放出する反応物が含まれます。一般に、発熱反応は常に熱力学的に有利であるか、低温でのみ有利です。
エンタルピーは熱力学的に重要であるため、化学者は反応エンタルピーを計算する多くの方法を開発してきました。この記事では、それぞれ異なるデータまたはリソースを使用する 4 つの最も重要な方法について説明します。
- 結合エンタルピー
- 形成エンタルピー
- 比熱
- 反応平衡
後でわかるように、反応物と反応について既に知っている情報に応じて、さまざまな状況でエンタルピーを取得するためのさまざまな方法が必要になります。
生成エンタルピーによるエンタルピーの計算
反応のエンタルピーを計算する最も簡単な方法は、化学者が「生成エンタルピー」と呼ぶものを使用することです。つまり、各分子には特徴的な「生成エンタルピー」があります。これは本質的に、それぞれの原子から分子を組み立てる際のエンタルピーの変化です。生成エンタルピーの詳細については、この記事をご覧ください。
反応における各分子の生成エンタルピーがわかっている場合は、反応の全体的なエンタルピー変化を計算できます。これを行うには、ヘスの法則として知られるエンタルピー式を使用する必要があります:
ΔHrxn =∑ΔHf,products – ∑ΔHf,reactants
まず、各分子の生成エンタルピーに反応式の化学量論係数を掛けます。次に、生成物のエンタルピーと反応物のエンタルピーを掛け合わせます。 3 番目に、生成物のエンタルピーと反応物のエンタルピーの合計を引き、全体の反応エンタルピーを計算します。
aA + bB → cC + dD
ΔHrxn =((c * ∆Hf,C ) + (d * ΔHf,D )) – ((a * ∆Hf,A ) + (b * ∆Hf,B ))
化学者は、実験、特に熱量測定を通じて分子の形成エンタルピーを知っているだけです。したがって、よく研究された温度 (25°C や 37°C など) でよく知られている分子を扱う場合にのみ、生成エンタルピーを使用できます。なじみのない分子や条件では、生成エンタルピーに関する情報がすぐに入手できない傾向があります。
計算例
25°C での次の反応のエンタルピーを計算してください:
Ca(OH)2 + (NH4 )2 CO3 → CaCO3 + 2NH4 ああ
| ΔHf (kJ/mol) | |
| Ca(OH)2 | -1003. |
| (NH4 )2 CO3 | -412.1 |
| CaCO3 | -1207 |
| NH4 ああ | -362.5 |
ΔHrxn =(ΔHf,CaCO3 + (2*ΔHf,NH4OH )) – (ΔHf,Ca(OH)2 + ΔHf,(NH4)2CO3 )
ΔHrxn =(-1207 + (2 * -362.5)) – ( -1003 + -412.1)) =-516.9 kJ/mol
この反応は発熱です。
結合エンタルピーによるエンタルピーの計算
反応のエンタルピーを計算する別の頻繁な方法には、結合エンタルピーの使用が含まれます。具体的には、2 つの原子間の各化学結合には、その形成におけるエンタルピー変化が伴います。結合エンタルピーの詳細については、この記事をご覧ください。
反応エンタルピーを計算するには、ヘスの法則と同様の方法を実装する必要がありますが、重要な違いがあります。
まず、反応の過程で形成または切断された各結合の結合エンタルピーを見つける必要があります。反応によって変化しないままの結合は、反応の全体的なエンタルピーに影響しません。次に、壊れた結合のすべてのエンタルピーと形成された結合のエンタルピーを合計します。 3 番目に、壊れた結合の追加エンタルピーを、形成された結合のエンタルピーで差し引いて、全体の反応エンタルピーを求めます。
ΔHrxn =∑ΔH壊れた絆 – ∑H形成された絆
ヘスの法則とは異なり、この方法は「生成物から反応物を引いたもの」ではなく、「壊れた結合から形成された結合を差し引いたもの」です。これは本質的に反対であるため、指摘することが重要です。新しく形成された結合は生成物に見られ、壊れた結合は反応物に見られます.
また、結合エンタルピーを使用すると、形成エンタルピーよりも多くの反応に使用できます。これにより、反応がよく知られた結合を含む限り、型にはまらない生成物と反応物の反応エンタルピーを計算できます。ただし、条件と絆の親しみやすさによって制限されます。
計算例
25°C での次の反応のエンタルピーを計算してください:
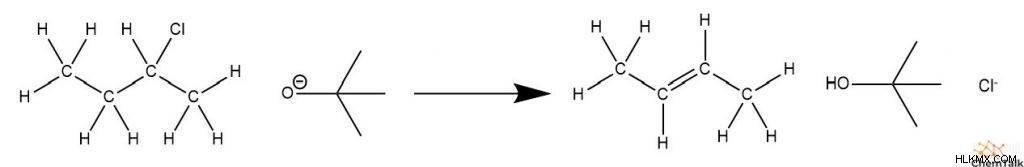
| ΔH絆 (kJ/mol) | |
| C~H | 412 |
| C-C | 348 |
| C-Cl | 338 |
| C=C | 612 |
| O-H | 463 |
ΔHrxn =(ΔHBond, C-H + ΔH結合、C-C + ΔH結合、C-Cl ) – (ΔH結合、C=C + ∆HBond, O-H )
注:アルケンの結合の 1 つだけが切断される場合、C=C 結合が切断され、C–C 結合が形成されると考えることができます。
ΔHrxn =(412 + 348 + 338) – (612 + 443) =43 kJ/mol
この反応は吸熱反応です。
比熱によるエンタルピーの計算
反応エンタルピーを計算するもう 1 つの簡単な方法は、物質の比熱を使用することです。それぞれの物質には「比熱」と呼ばれる性質があり、物質の温度を上げるエネルギー量を表しています。比熱について詳しく知りたい場合は、この記事をチェックしてください。
このアプローチには、反応による熱交換の測定が含まれ、最初の 2 つよりもはるかに直接的で実験的なものになります。
定義上、化学反応にはいくつかの物質が他の物質に変化することが含まれるため、生成物と反応物の比熱は反応エンタルピーに影響しません。代わりに、反応環境の比熱を見ることができます。
反応を容器に隔離すると、容器内の空気の温度変化を監視することで、反応によって放出される熱を測定できます。この場合、空気が反応媒体として機能し、比熱は 1.01 J/(g°C) です。代わりに、水溶液中で反応を観察すると、比熱が 4.18 J/(g°C) の水が媒体として機能します。
熱を見つけるには、次の式を使用する必要があります:
q=mCΔT
q:反応媒体から吸収または放出される熱 (ジュール単位)
m:反応媒体の質量 (グラム)
C:反応媒体の比熱 (J/(g°C))
ΔT:反応媒体の温度変化 (摂氏)
ほとんどの場合、反応媒体によって交換される熱量は、反応のエンタルピーに等しくなります。唯一の例外は、「一定の圧力」の条件が満たされない場合です。ただし、システムの圧力は、反応にガスが含まれ、生成物と反応物の間に不等モルのガスが存在する場合にのみ変化します。
計算例
NaOH と HCl それぞれ 1 モルが反応して、1.00L (1000g) の水中で NaCl と H2O を生成します。その後、水温は 13.7°C 上昇します。反応エンタルピーを求めてください。
NaOH + HCl → NaCl + H2 O
q =mC∆T =(1000g)(4.18 J/(g°C))(13.7°C) =57.2 kJ/mol
注:水が吸収する熱を計算したので、反応によって放出される熱を得るには符号を反転する必要があります。
ΔHrxn =-q=-57.2 kJ/mol
この反応は発熱です。
平衡定数によるエンタルピーの計算
反応の平衡定数を使用して、反応エンタルピーを解くこともできます。これは、生成物と反応物の平衡比率を表す値です。平衡定数について詳しく知りたい場合は、この記事をご覧ください。
この方法は、エンタルピーを計算する別の実験的方法を表しています。具体的には、反応の熱力学的特性とその平衡動力学との関係を利用します。反応種によっては、分光測光法を使用して平衡濃度を簡単に測定でき、簡単なエンタルピー情報が得られます。
平衡定数を使用してエンタルピーを求めるには、生成物と反応物の平衡濃度を 2 つの異なる温度で測定する必要があります。次に、化学者が Van’t Hoff エンタルピー方程式と呼ぶものを使用して、反応のエンタルピーを見つけることができます。
lnK
K
K
T1 :温度 1 (ケルビン度)
T2 :温度 2 (ケルビン度)
R:理想気体定数 (8.314 J/molK)
計算例
フラスコに 1.0M の反応物 A と 2.0M の反応物 B があり、次の反応を観察します:
A + 2B → C
25°C では、次の平衡濃度が観察されます:
[A]=0.70M
[B]=140万
[C]=0.30M
50°C では、次の平衡濃度が観察されます:
[A]=0.44M
[B]=0.88M
[C]=0.54M
反応エンタルピーを計算します。
T1 =298K T2 =323K
K
ln(1.6) – ln(0.39) =(-ΔHrxn /8.314)((1/323K)-(1/298K))
ΔHrxn =-8.314(ln(1.6) – ln(0.39))/(( 1/323)-(1/298)) =9.1 J/mol
この反応は吸熱反応です。