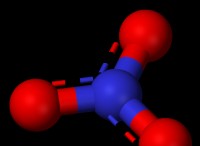
* 極性の問題: 極性物質は不均一な電荷分布を持ち、正と負の末端(水など)を生み出します。イオン化合物はイオンで作られており、イオンは正と負の電荷もあります。
* 魅力と解散: 極性分子の正の端は、イオン化合物の陰イオンを引き付け、逆も同様です。これらの魅力は、イオン化合物を一緒に保持する力を克服し、それを溶解させます。
例:
* 水中の塩(NaCl): ナトリウムイオン(Na+)は水分子の負の酸素末端に引き付けられ、塩化物イオン(Cl-)は陽性の水素端に引き付けられます。この相互作用は、イオン結合を塩で破壊し、溶解することができます。
例外:
ほとんどのイオン化合物は極性溶媒に溶解しますが、例外があります。
* 溶解度ルール: 特定のイオン化合物には特定の溶解性ルールがあります。たとえば、炭酸塩または硫酸塩を含む一部のイオン化合物は一般に不溶性です。
* 格子エネルギー: 一部の化合物のイオン結合の強度は非常に高くなる可能性があり、極性溶媒でも溶解性が低下します。
要約: 一般的な原則は、イオン化合物がイオンと極性分子の間の静電引力のために極性物質に溶解する傾向があるということです。ただし、特定のイオン化合物とその特性に基づいたいくつかの例外があります。