酸塩基中和反応とは?
酸塩基中和反応は、酸が塩基と反応して水と塩を生成するときです。
酸からのプロトン (H) は、塩基からの水酸化物 (OH) と結合して水 (H

このタイプの反応は、酸と塩基を中和するため、中和反応と呼ばれます。強酸と強塩基が完全に反応した場合 (それぞれのモル数が等しいことを意味します)、結果として得られる溶液の pH は 7 (中性) になります。
中和反応も二重置換反応の一種です。
中和反応の生成物は何ですか?
中和反応の生成物は常に水 (H2 O)と塩。形成される塩は、使用する酸と塩基によって異なります。塩は可溶性で溶液に溶けるか、不溶性で溶液から沈殿する可能性があります.
強酸強塩基中和反応
強酸と強塩基の完全な中和は、強酸と強塩基のモル量が等しい場合に起こります。その結果、pH 7 の水溶液になります。
強酸、強塩基はあまりありません。以下はそれらすべての表です。
| 強酸 | 強力なベース |
| HCl | LiOH |
| HBr | NaOH |
| こんにちは | コウ |
| HNO3 | Ca(OH)2 |
| H2 SO4 | RbOH |
| HClO3 | Sr(OH)2 |
| HClO4 | CsOH |
| Ba(OH)2 |
弱酸または弱塩基による中和
弱酸または弱塩基との反応では、通常、pH 7 にはなりません。それでも水と塩が生成されます。
反応に弱酸と強塩基が含まれる場合、結果の pH はわずかに塩基性 (pH> 7) になります。
中和反応に強酸と弱塩基が含まれる場合、結果として得られる pH はわずかに酸性 (pH <7) になります。
酸と塩基の両方が弱い場合、最終的な pH は pK
| 酸性タイプ? | 基本タイプ? | 中和 pH |
| 強酸 | 強力な基盤 | pH =7 |
| 強酸 | 弱いベース | pH <7 (酸性) |
| 弱酸 | 強力な基盤 | pH> 7 (基本) |
| 弱酸 | 弱いベース | pK |
問題例
水中で HCl と NaOH の反応があるとします。製品はどうなりますか?これはどのような反応ですか?正味のイオン方程式は?
HClは強酸です。 NaOHは強塩基です。酸と塩基の両方が存在するため、酸塩基の中和反応があることがわかります。
中和反応の生成物は、必ず水と塩になります。この場合、塩は NaCl です。ナトリウムイオンは強塩基に由来し、塩化物イオンは強酸に由来します.
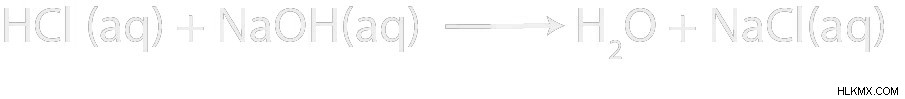
次に、正味のイオン方程式 (NIE) を書きたいと思います。私たちの反応の種のいくつかは水性であるため、式を単純化できるはずです。方程式の両側に現れるスペクテーター イオンを取り除くことによって、正味のイオン方程式を取得します。この場合、それは Cl と Na です。
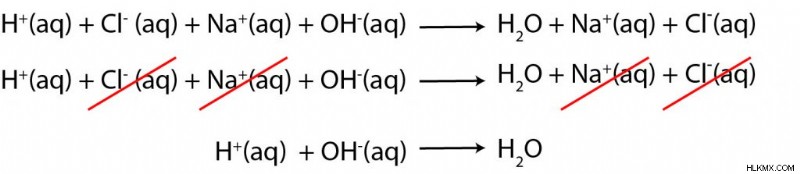
その結果、塩基からの水酸化物 (OH) との酸反応によるプロトン (H) が生成され、水が生成されます!
実際の例
料理では酸塩基の中和反応がよく使われます!たとえば、ケーキを焼くときに重炭酸塩 (重曹) を材料として加えることがよくあります。重曹がベースです。具材の中には酸味も!一般的なものは、レモン汁、酢、またはクリームです。調理中に酸と塩基が反応すると、水 (すべての中和反応がそうであるように!) と二酸化炭素が生成されます。二酸化炭素の泡が、ケーキ (およびその他の焼き菓子) をふわふわで軽いものにします!
自宅でできる実験については、Science is Fun のこの実験をチェックしてください!

その他の関連記事
- 酸塩基理論
- 酸塩基化学
- 酸と塩基の性質