イオン結合:
* 固体状態でより強い: イオン結合は、主に反対に帯電したイオン間の静電魅力です。固体状態では、これらのイオンは結晶格子にしっかりと詰め込まれており、強い内性力につながります。これにより、イオン化合物は一般に融点と沸点が高くなります。
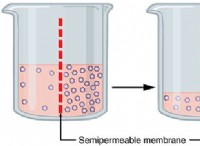
* 液体または溶解状態の弱い: イオン化合物が溶けたり溶けたりすると、イオンは分離して自由に移動します。それらの間の静電力は著しく弱くなり、イオン間の魅力が低下します。
共有結合:
* 一般的に強い: 共有結合には、原子間の電子の共有が含まれます。これらの共有電子は、原子間に強い魅力を生み出し、安定した分子をもたらします。 共有結合は通常、イオン結合よりも強いです。
* 強度のバリエーション: 共有結合の強度は、次のような要因に依存します。
* 電気陰性の差: 結合された原子間の電気陰性度の大きな違いは、より多くの極性共有結合につながりますが、これは一般的に強くなります。
* 債券注文: 複数の結合(ダブル、トリプルボンド)は、単一結合よりも強いです。
* 結合長: 一般的に短い結合はより強いです。
概要:
* 一般に、共有結合はイオン結合よりも強いです。
* イオン結合強度は、物質の状態に大きく依存しています: 固体が強く、液体または溶液が弱い。
* 共有結合強度は、電気陰性の差、結合順、結合長などの要因によって異なります。
例:
* 塩化ナトリウム(NaCl): 固体状態で強い(高融点)が強いが、水に容易に溶け、イオンに分解する古典的なイオン化合物。
* ダイヤモンド: 共有結合した炭素原子のネットワークであり、最も困難な既知の材料の1つとなっています。
化学結合について他に質問がある場合はお知らせください!