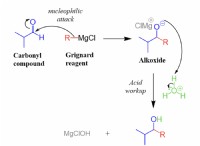
1。化学量論:
* 方程式のバランス: 反応物と生成物のモルの数は、バランスのとれた化学式の両側で等しくなければなりません。両側のガスの総モルを知っている場合、化学量論係数を調整することにより、方程式のバランスをとるのに役立ちます。
* 製品量の予測: 反応物の出発モルを知っている場合は、バランスの取れた方程式を使用して、形成すべき生成物の理論的モルを計算できます。
2。理想的なガス法アプリケーション:
* ボリュームの変更: 反応が一定の温度と圧力で発生した場合、理想的なガス法(PV =NRT)を使用して、ガスのモル数の変化を体積の変化に関連付けることができます。たとえば、ガスの総モルが減少すると、体積も減少します。
* 圧力の変化: 体積の変化と同様に、温度が一定の場合、ガスのモル数の変化は、理想的なガス法に従って圧力に直接影響します。
3。平衡計算:
* 平衡のシフト: 反応が可逆的である場合、ガスのモル数の変化は平衡の位置に影響を与える可能性があります。 たとえば、製品側でガスの総モルが増加すると、平衡は反応物を支持するためにシフトする可能性があります。
重要な考慮事項:
* 物質状態: ガスのモル数は、気体状態の物質のみを指します。すべての反応物と製品の段階を考慮する必要があります。
* 実際のガス: 理想的なガス法は、多くのガスに適切な近似を提供しますが、実際のガスは、特に高圧または低温で理想的な行動から逸脱する可能性があります。
例:
反応を考えてみましょう:
`` `
n2(g) + 3h2(g)⇌2nh3(g)
`` `
* バランス: 方程式はバランスが取れており、反応物側の4モルのガス(1モルN2 + 3モルH2)が製品側の2モルのガスに変換されていることがわかります(2モルNH3)。
* ボリュームの変更: 一定の温度と圧力では、ガスモールの数が減少するため、反応混合物の体積は反応が進むにつれて減少します。
特定のシナリオを念頭に置いている場合はお知らせください。これらの概念を適用するお手伝いをさせていただきます。