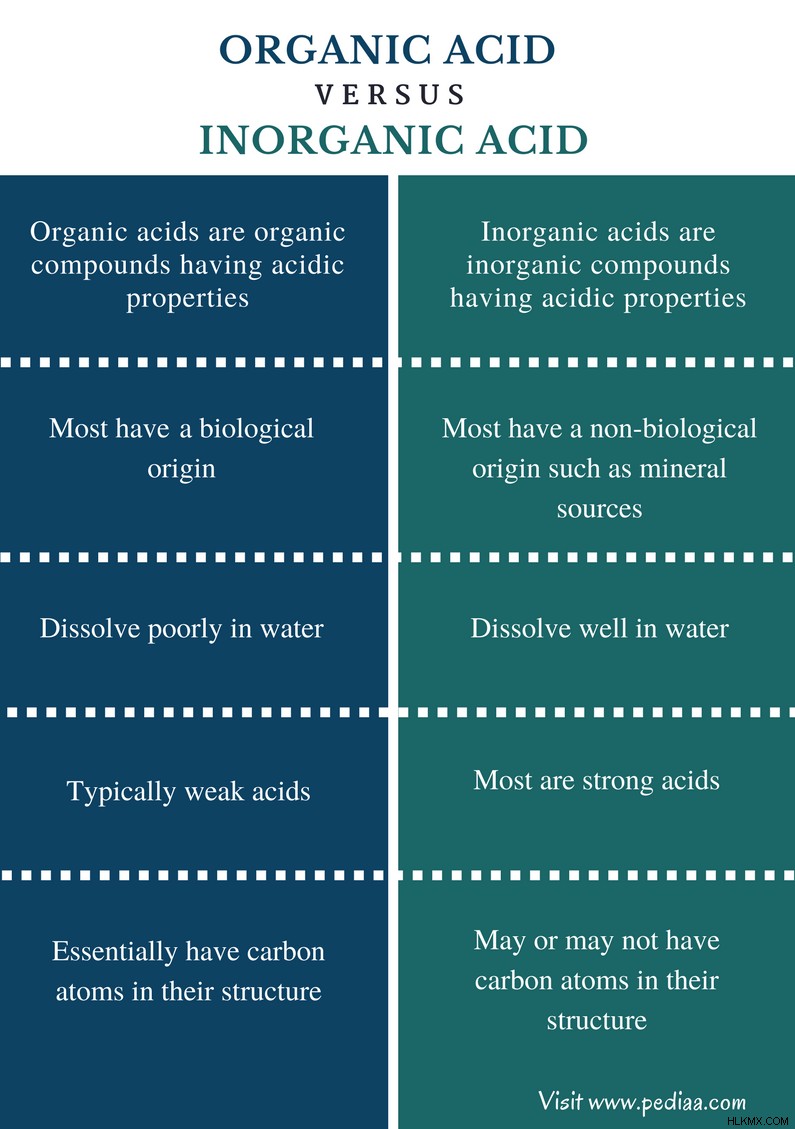
主な違い – 有機酸と無機酸
一般に、酸は塩基を中和できる化合物です。酸はヒドロニウムイオン (H3 O) 水に加えた場合。通常、酸は室温で液体である腐食性物質です。酸は、プロトン (H) イオンを溶液に供与するか、溶液中に存在する電子が豊富な化合物から電子対を受け取ることができます。有機酸と無機酸の主な違いは、有機酸は酸性の性質を持つ有機化合物であり、通常は弱酸であることです。 一方、無機酸は酸性の性質を持つ無機化合物であり、そのほとんどは強酸です。
対象となる主な分野
1.有機酸とは
– 定義、構造、プロパティ
2.無機酸とは?
– 定義、構造、プロパティ
3.有機酸と無機酸の違い
– 主な違いの比較
重要な用語:酸、カルボン酸、ヒドロニウム イオン、無機酸、無機酸、有機酸、pH 値、強有機酸、弱有機酸
有機酸とは?
有機酸は、酸性の性質を持つ有機化合物です。これらは有機化合物であるため、有機酸は構造内に炭素原子を持っている必要があります。最も一般的なタイプの有機酸はカルボン酸です .カルボン酸の分子式は、RCOOHで表すことができます。酸性の原因となる官能基は-COOHです。このグループの水素原子は、H イオンとして放出できます。これは、酸素原子が電子に富み、H 原子よりも電気陰性度が高いためです。したがって、この H 原子は –COOH 基から容易に分離できます。
酸性の特性により、有機酸は7未満のpH値を示します .これらの酸は青リトマス赤に変わり、酸味があります。有機酸には 2 種類あります。
- 強い有機酸
- 弱有機酸
弱酸は、溶液中で共役塩基および H+ イオンと平衡状態で存在しますが、強酸は完全に解離しており、水溶液中では平衡状態にありません。ほとんどの有機酸は、水中で部分的に解離するため、弱酸 (例:エタン酸) です。しかし、ほとんどすべての有機酸は有機溶媒に溶解しています。解離後に形成される陰イオンの安定性により、有機酸は強酸または弱酸になります。
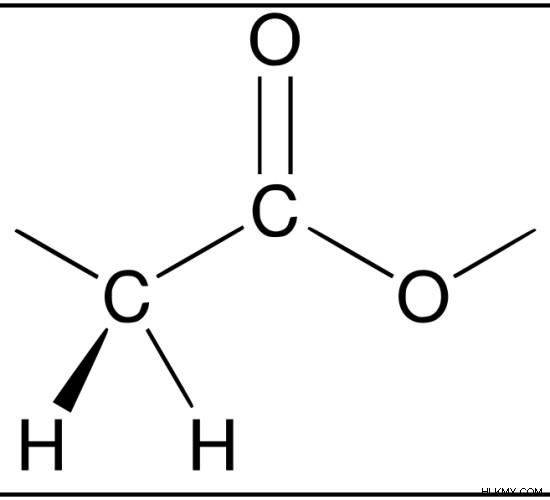
図 1:酢酸は有機酸です。酢に含まれています。
無機酸とは?
無機酸は、酸性の性質を持つ無機化合物です。これは、無機酸化合物が水溶液に H イオンを供与したり、電子が豊富な化合物から電子対を受け取ったりできることを意味します。無機酸は鉱酸とも呼ばれます .一部の無機酸には構造内に酸素原子が含まれていますが、一部の無機酸には含まれていません。たとえば、H2SO4 は酸素原子を含む無機酸です。しかし、別の無機酸である HCN には酸素原子がありません。
有機酸とは異なり、無機酸は本質的にその構造に炭素原子を持っていません。一部の無機酸には炭素原子が含まれる場合がありますが、他の無機酸には含まれない場合があります。例えば、HCNは無機酸ですが、炭素原子を持っています。 HCN は、有機化合物とは異なり、水中では C-H 結合のみが容易に H イオンと CN イオンに解離するため、有機酸ではありません。
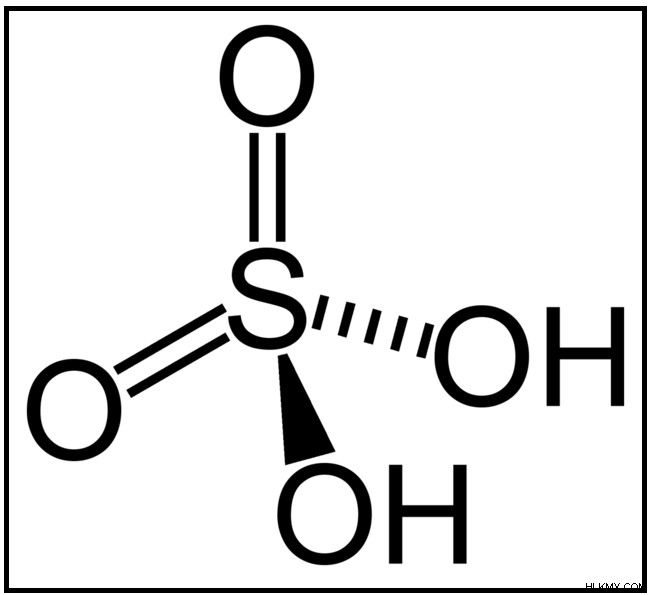
図 2:無機酸である硫酸の構造
有機酸と無機酸の違い
定義
有機酸: 有機酸は、酸性の性質を持つ有機化合物です。
無機酸: 無機酸は、酸性の性質を持つ無機化合物です。
起源
有機酸: ほとんどの有機酸は生物由来です。
無機酸: ほとんどの無機酸は、ミネラル源などの非生物学的起源を持っています.
水への溶解度
有機酸: 有機酸は水に溶けにくい。
無機酸: ほとんどの無機酸は水によく溶けます。
酸度
有機酸: 有機酸は通常、弱酸です。
無機酸: ほとんどの無機酸は強酸です。
原子の組成
有機酸: 有機酸は基本的にその構造に炭素原子を持っています。
無機酸: 無機酸は、その構造に炭素原子を含む場合と含まない場合があります。
結論
有機酸と無機酸の両方が、塩基の中和、プロトン (H イオン) の供与や電子対の受容、青リトマスを赤に変えるなどの酸性特性を示します。どちらの物質もヒドロニウムイオン (H