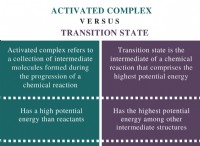
初期状況:
* 酸性溶液: 7未満のpHの溶液。これは、水酸化物イオン(OH-)よりも水素イオン(H+)の濃度が高いことを意味します。
* アルカリ(ベース): 溶液中の水酸化物イオン(OH-)の濃度を増加させる物質。
アルカリ(ベース)の追加:
1。中和: ゆっくりとアルカリを加えると、アルカリからの水酸化物イオン(OH-)が酸から水素イオン(H+)と反応します。この反応は、中性である水(H2O)を形成します。
* H + + OH-→H2O
2。 pHの増加: 反応が酸を中和すると、水素イオン(H+)の濃度が減少します。これにより、pHが上昇します。
3。バッファリング: 弱酸に弱いアルカリを追加すると、pHの変化が比較的遅いバッファリング期間があるかもしれません。これは、弱酸とそのコンジュゲートベース(アルカリとの反応によって形成される)が、大きなpHの変化に抵抗するバッファシステムを形成するためです。
4。等価点: 最終的には、アルカリのモルが存在する酸のほくろとまったく等しいポイントに到達するでしょう。これが同等のポイントです。この時点で、溶液は中性です(pH 7)。
5。等価ポイントを超えて: 等価点を超えてアルカリを追加し続けると、溶液は7を超えるpHでアルカリ(塩基性)になります。過剰な水酸化物イオンが溶液を支配します。
例:
水酸化ナトリウム(NAOH)を塩酸(HCl)に追加することを想像してください。
* 初期: HCLは酸性です(pH <7)
* naohの追加: NaOHはHClと反応して、中性塩である水(H2O)と塩化ナトリウム(NaCl)を形成します。
* 等価ポイント: すべてのHClが中和されると、pHは7になります。
* 等価ポイントを超えて: NAOHを追加すると、ソリューションが基本的になります(pH> 7)。
キーテイクアウト:
*アルカリを酸性溶液に追加すると、pHが増加します。
* pHの変化は、等価ポイントに到達するまで段階的になります。
*等価ポイントを超えて、溶液はアルカリ性になります。
他に質問がある場合はお知らせください!