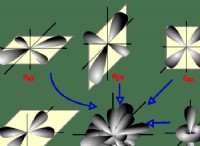
1。結合の違い:
* イオン化合物: 正に帯電した陽イオンと負に帯電した陰イオンの間の強い静電力によって結合されます。
* 有機化合物: 主に共有結合によって一緒に保持され、そこでは電子が原子間で共有されます。
2。極性:
* イオン化合物: 陽イオンと陰イオン間の電気陰性度の大きな違いにより、非常に極性。
* 有機化合物: 存在する官能基に応じて、極性または非極性である場合があります。ほとんどの有機化合物は非極性またはわずかに極性です。
3。分子間力:
* イオン化合物: イオン間の強い相互作用、高度に組織化された結晶格子構造を作成します。
* 有機化合物: ファンデルワールス力、双極子双極子相互作用、または水素結合などのより弱い分子間力。
4。溶媒和:
* イオン化合物: イオン化合物が溶解するためには、溶媒分子は、イオンを一緒に保持する静電力を克服するのに十分な強力な相互作用を持たなければなりません。
* 有機化合物: 非極性有機溶媒は、極性イオン化合物と効果的に相互作用することはできません。
5。 「ように溶けるように」原則:
*この原則によると、同様の極性のある物質は互いに溶解する傾向があります。
*イオン化合物は極性であり、ほとんどの有機化合物は非極性であるため、混和しません。
例外:
この原則にはいくつかの例外があります。一部のイオン化合物は、次のような特定の条件下で有機溶媒にわずかに溶けます。
* 機能グループの存在: 有機溶媒に極性官能基が含まれている場合、イオンとある程度相互作用できます。
* 複合体の形成: 特定のイオンは、有機分子と複合体を形成し、溶解度を向上させることができます。
要約:
イオン化合物は一般に、有機溶媒中のより弱い分子間力によってイオン間の強い静電相互作用が効果的に克服されないため、一般に有機化合物に不溶です。 「同様の溶解」原理は、溶解度を決定する際の極性の重要性を強調しています。