主な違い - 軌道とエネルギー準位
すべての原子は、電子に囲まれた陽子と中性子でできた原子核で構成されています。これらの電子は原子核の周りを絶え間なく動いています。したがって、原子内の電子の特定の位置を示すことはできません。電子の正確な位置を特定する代わりに、科学者は「確率」の概念を導入しました。つまり、電子が移動している可能性が最も高い経路が決定されます。この経路は軌道と呼ばれます。これらの軌道は、これらの軌道内の電子が構成するエネルギーの量に従って配置されます。これらはエネルギー準位と呼ばれます。軌道とエネルギー レベルの主な違いは、軌道は原子核の周りを運動している電子の最も可能性の高い経路を示し、エネルギー レベルは軌道が持つエネルギー量に応じて軌道の相対的な位置を示すことです。>
対象となる主な分野
1.軌道とは
– フォーメーション、プロパティ、アレンジメント
2.エネルギーレベルとは
– フォーメーション、プロパティ、アレンジメント
3.軌道とエネルギー準位の関係
– 軌道とエネルギー準位
4.軌道とエネルギー準位の違いは何ですか
– 主な違いの比較
重要な用語:原子、d 軌道、電子、エネルギー準位、軌道、確率、p 軌道、s 軌道
軌道とは
軌道は、原子核の周りに電子が存在する可能性が最も高い領域として定義できます。原子レベルでは、軌道の最も正確な名前は原子軌道です。原子軌道は、球形やダンベル形など、いくつかの形で存在する場合があります。軌道は、原子核の周りを運動している電子の最も可能性の高い経路を示します。
原子核の周りに見られる軌道にはいくつかの種類があります。それらのいくつかを以下に説明します。
軌道
これらは球形の軌道です。同じエネルギー準位では、s 軌道のエネルギーが最も低くなります。 s 軌道が保持できる電子の最大数は 2 です。これらの 2 つの電子は反対のスピンにあるため、2 つの電子間の反発が最小限に抑えられます。
p軌道
これらは、s 軌道よりも高いエネルギーを持つダンベル型の軌道です。 p 軌道が保持できる電子の最大数は 6 です。これは、1 つの p 軌道が px という名前の 3 つのサブ軌道で構成されているためです。 、py と pz .これらの軌道はそれぞれ、最大 2 個の電子を保持できます。
d 軌道
これらの軌道は、同じ面にある 2 つのダンベルのように見えます。ただし、s軌道やp軌道よりも複雑な立体構造です。 1 つの d 軌道は、5 つの部分軌道で構成されています。各準軌道は最大 2 個の電子を保持できます。したがって、d 軌道が保持できる電子の最大数は 10 です。
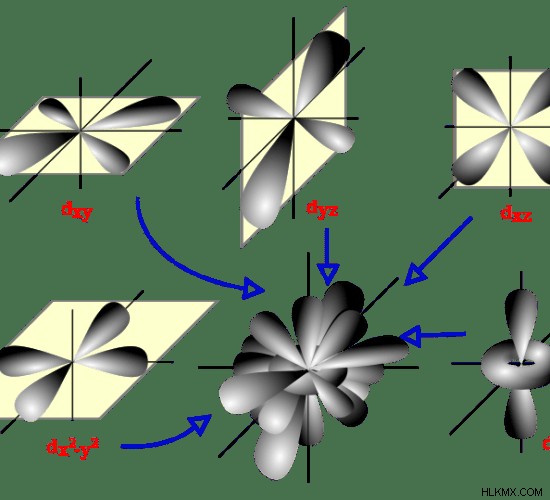
図 1:原子軌道の形状
分子軌道理論によると、2 つの原子軌道が重なると分子軌道が形成されます。この分子軌道は、共有結合の形成を示します。したがって、軌道は化学結合に直接関与しています。
エネルギー レベルとは
原子核の周りにある電子殻はエネルギー準位と呼ばれます。これらのシェルには、個別のエネルギー値があります。電子は、これらのエネルギー レベルまたはシェルを満たします。これらのエネルギー準位は、K、L、M、N などと名付けられます。最もエネルギーの低いエネルギー準位が K です。これらのエネルギー準位には、エネルギーの昇順に従って電子が満たされます。言い換えれば、電子は最初に最も低いエネルギー準位まで満たされます。そうすることで、原子を安定させることができます。
各エネルギー レベルが保持できる電子の数は決まっています。これらの数値を以下に示します。この数は、各エネルギー準位を構成する軌道の数によって異なります。
1エネルギーレベル – 2
2 エネルギー レベル – 8
3 エネルギー レベル – 8
4 エネルギー レベル – 8
これは、1 エネルギー準位を除く他のすべてのエネルギー準位が最大 8 個の電子を保持できることを示しています。
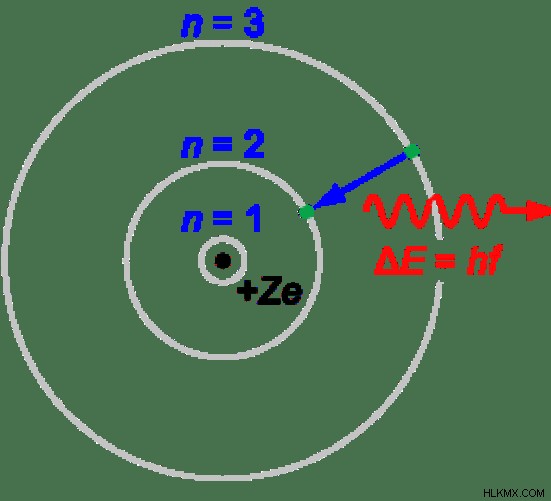
図 2:原子のエネルギー準位。記号「n」はエネルギー レベルを示します。
電子は、エネルギーを吸収または放出することによって、これらのエネルギー レベル間を移動できます。原子にエネルギーが与えられると、エネルギーの低い準位にある電子が、エネルギーの高い準位に移動することができます。この新しい状態は励起状態と呼ばれます。ただし、この励起状態は安定ではありません。したがって、この電子はエネルギーを放出して基底準位に戻る可能性があります。これらのプロセスは電子遷移と呼ばれます。
軌道とエネルギー準位の関係
- 原子の軌道は、エネルギーに従って配置されます。したがって、エネルギー準位は軌道で構成されます。
軌道とエネルギー準位の違い
定義
軌道: 軌道は、原子核の周りに電子が存在する可能性が最も高い領域です。
エネルギーレベル: エネルギー準位は、原子核の周りにある電子殻です。
命名
軌道: 軌道は、s、p、d、および f と名付けられています。
エネルギーレベル: エネルギー準位は、K、L、M、N と名付けられています。
電子数
軌道: 軌道は、s=2、p=6、d=10 などの軌道に応じて最大数の電子を保持できます。
エネルギーレベル: 最初のエネルギー準位は 2 個の電子で構成され、他のすべてのエネルギー準位は最大 8 個の電子を保持できます。
結論
軌道は電子で構成されています。エネルギー準位は、軌道のエネルギーに従って、原子の周りの軌道の配置を示します。軌道とエネルギー準位の主な違いは、軌道は原子核の周りを運動している電子の最も可能性の高い経路を示すのに対し、エネルギー準位は軌道が持つエネルギーの量に応じて軌道の相対的な位置を示すことです.
画像提供:
1. T ユーザーによる「D 軌道」:Commons Wikimedia 経由の Sven(CC BY-SA 3.0)
2. 英語版 Wikipedia の JabberWok による「Bohr-atom-PAR」(CC BY-SA 3.0)、Commons 経由ウィキメディア