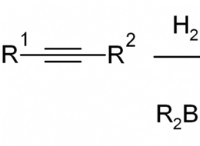これがバランスの取れた化学式です:
2ch₃cooh(aq) + ba(oh)₂(aq)→ba(ch₃coo)₂(aq) + 2h₂o(l)
説明:
* 酢酸(Ch₃COOH) 弱酸です。
* 水酸化バリウム(BA(OH)₂) 強いベースです。
* 酢酸バリウム(BA(Ch₃COO)₂) 塩が形成されています。水に溶けます。
* 水(h₂o) 副産物として生成されます。
観測:
*反応は発熱性であり、熱が放出されます。
*反応が進むにつれて、ソリューションは酸性度が低く、より基本的になります。
*フェノルフサレインインジケーターを使用すると、反応が進行するにつれてソリューションは無色からピンクに変わります。
正味イオン方程式:
正味のイオン方程式は、反応に直接関与している種に焦点を当てています。
2H⁺(aq) + 2oh⁻(aq)→2h₂o(l)
この方程式は、反応が基本的に酸からの水素イオン(H⁺)と塩基からの水酸化物イオン(OH⁻)の組み合わせであることを示しています。