コア コンセプト
このチュートリアルでは、別のタイプの消去反応を紹介します。 有機化学に見られる E2 .この反応をさらに理解するために、メカニズムと例を見ていきます。
まず、E1 Elimination Reactions のチュートリアルを必ずお読みください!
他の記事で取り上げるトピック
- Sn1置換
- Sn2 置換
- 求電子剤
- 求核剤
語彙
- アルケン – 二重 (パイ) 結合
- カルボカチオン – 正電荷を帯びた炭素イオンを含む分子
- 脱プロトン – 分子からプロトン (H イオン) を除去する行為
- イオン化 – 電子の除去または付加によって分子が正または負の電荷を得るプロセス
- 出発 グループ – 分子から離脱できる原子またはグループ
- メカニズム – 電子と分子の動きを矢印で示す反応の視覚的プロセス
- 立体化学 – 分子内のコンポーネントの物理的な向き
- 立体特異性 – 最初の反応物の立体化学は、分子がどのように反応し、最終生成物の立体化学を決定するかにおいて役割を果たします
脱離反応とは?
脱離反応は、隣接する炭素から 2 つの単結合を除去することによる C-C 二重結合の形成で構成されます。炭素に結合した脱離基と隣接する炭素に結合した水素は、通常、これらのタイプの反応で切断される 2 つの結合です。
E2 は二次二分子反応であり、速度は分子と補助塩基の両方の濃度に依存します。以下の E2 排除について説明しましょう!
E2 メカニズム
E2 は、中間体のない 1 ステップの反応メカニズムです:

B から H を指す矢印は、炭素を脱プロトン化する水素をつかむ求核試薬またはルイス塩基を示します。同時に、脱離基が分子から離れ、完全なオクテットの電子を一緒に取り、その炭素をイオン化します。これは、C-X 結合から X を指す矢印で示されます。脱プロトン化された炭素は、一時的な負電荷を隣接するカルボカチオンと共有します。これは、C-H 結合から C-C 結合に向かう矢印から示されます。これにより、中性アルケン生成物に二重結合が作成されます。
このプロセス全体は、2 段階で行われる E1 反応とは異なり、1 段階で行われます。
E2 反応の立体特異性
繰り返しになりますが、塩基がどの水素をつかむかを決定するという問題があります。 E2 反応では、生成物は分子の立体化学に依存します。脱離基と水素は互いに「アンチ」でなければなりません。つまり、分子の反対側 (180 度離れた位置) にある必要があります。この反応では脱プロトン化とイオン化が同時に起こっているため、十分なスペースを確保するには、分子の 2 つの部分が互いにできるだけ離れている必要があります。
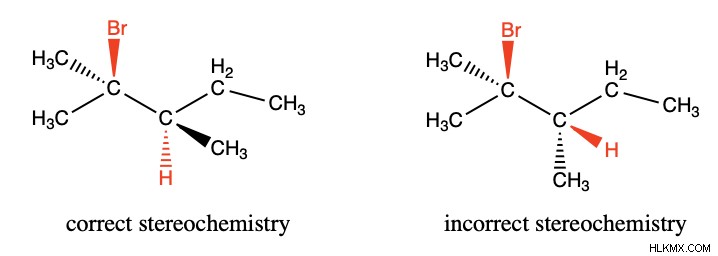
この概念を頭の中で視覚化するのは難しいかもしれないので、E2 反応における正しい立体化学と正しくない立体化学の例を次に示します。正しい分子では、脱離基がくさびの上にあり、水素がダッシュの上にあり、それらが反対方向に「突き出ている」ことを示しています。これにより、求核剤が分子を脱プロトン化すると同時に、脱離基が離れます。正しくない分子では、脱離基と水素の両方がウェッジ上にあります。これでは、反応が起こるのに十分なスペースがありません.
E2 反応の例
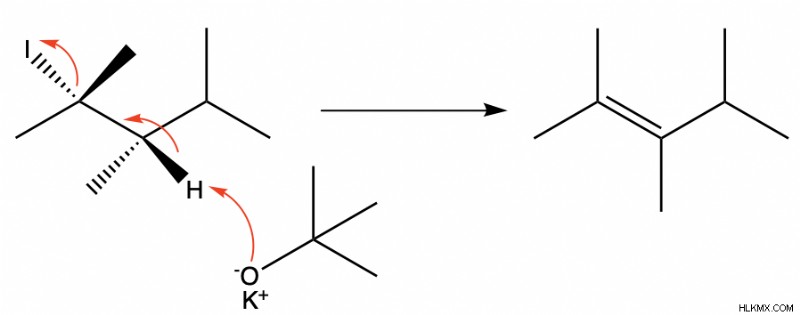
これは、E2脱離を受ける炭化水素鎖の例です。 C-I 結合から I への矢印で示されているように、ヨウ素脱離基が脱離します。同時に、塩基である tert-ブチルオキシドが、脱離基に対して「アンチ」である水素をつかみます。これは、塩基の酸素から水素を指す矢印で表示されます。次に、一時的に負に帯電した炭素と隣接するカルボカチオンが別の結合を形成して、中性のアルケン生成物を生成します。これは、C-H 結合から C-C 結合を指す矢印で示されています。
さらに読む
- E1 対 E2
- アルカンの命名
- シクロアルカンの命名
- 立体障害
- 絆エネルギー
- 凝縮反応