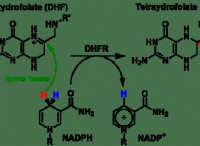
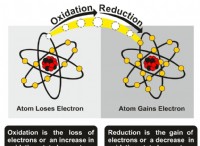
キーポイント:
* 酸性度: プロトン(H+)をベースに寄付する分子の能力。
* プロトン: 正に帯電した水素原子(H+)。
* 酸性プロトン: 分子から比較的簡単に除去できるプロトン。これは、結果の共役ベースの安定性によって決定されます。
酸性度に影響する要因:
いくつかの要因は、分子の陽子が酸性かどうかを決定します。
1。電気陰性度: より電気陰性の原子(酸素、窒素、ハロゲンなど)は、電子を自分に向けて引き付け、水素原子をより正しく、陽子として除去しやすくします。
2。ハイブリダイゼーション: プロトンを保持しているハイブリッド軌道のS-Characterが多いほど、酸性が高くなります。これは、S軌道が核に近いため、水素原子が電子不足で除去が容易になるためです。
3。共鳴: 結果として得られる共役塩基が共鳴によって安定化されると、陽子はより酸性です。 Resonanceは負電荷を非局在させ、ベースをより安定させます。
4。誘導効果: 陽子近くの電子吸引基は、それをより酸性にすることができます。これらのグループは、電子密度をプロトンから引き離し、より正しく除去しやすくします。
5。溶媒効果: 溶媒は酸性度にも影響を与える可能性があります。プロティック溶媒(水のような)は、共役ベースを安定させることができ、プロトンをより酸性にします。
例:
* カルボン酸(R-COOH): カルボン基の酸素に付着した水素原子は、生じるカルボキシル酸イオンが共鳴によって安定化されるため、酸性です。
* アルコール(R-OH): アルコキシドイオンは共鳴によって安定化されていないため、酸素に付着した水素原子はカルボン酸よりも酸性度が低くなります。
* 水(H2O): 水酸化物イオンは比較的強い塩基であるため、水中の水素は弱く酸性です。
要約: 酸性プロトンは、酸塩基反応でプロトンとして簡単に除去できる水素原子です。その酸性度は、電気陰性度、ハイブリダイゼーション、共鳴、誘導効果などの要因に影響されます。