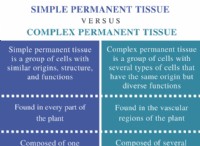
バッファーの理解
* H3PO4(リン酸): これは弱酸です。水中で部分的にイオン化し、H+イオンを放出します。
* nah2po4(リン酸二水素ナトリウム): これは弱酸の塩であり、溶液中の共役ベース(H2PO4-)を提供します。
バッファの仕組み
バッファーの鍵は、少量の酸または塩基が追加されたときにpHの変化に抵抗する能力です。このバッファーは次のように機能します:
* 添加酸を中和する(H+): バッファー溶液中のH2PO4-イオンは、追加されたH+イオンと反応してH3PO4を形成するため、添加酸を消費します。
* h2po4-(aq) + h +(aq)⇌H3po4(aq)
* 追加のベースを中和する(OH-): バッファー溶液中のH3PO4は、追加されたOHイオンと反応してH2PO4-と水を形成します。
* h3po4(aq) + oh-(aq)⇌h2po4-(aq) + h2o(l)
方程式
a。少量の酸を中和する:
要求した方程式は、追加された酸を中和する方程式です。
h2po4-(aq) + h +(aq)⇌H3po4(aq)
b。 少量のベースの中和:
追加されたベースを中和する方程式は次のとおりです。
h3po4(aq) + oh-(aq)⇌h2po4-(aq) + h2o(l)
キーポイント
* 平衡: バッファシステムに関与する反応は可逆的であるため、追加された物質に応じて右または左に移動できます。これが、バッファが酸と塩基の両方を処理できる理由です。
* バッファ容量: バッファーは、pHの変化に抵抗する能力が限られています。 酸やベースが多すぎると、バッファーが圧倒され、pHが大幅に変化します。