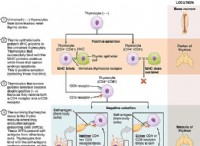
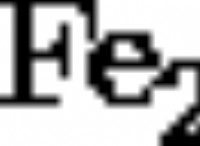塩酸(HCl):
* ソリューションでガスオフ: 濃縮されたHCl溶液は、その揮発性のためにHCLガスを放出します。これは、溶液を加熱または空気にさらされた場合に特に顕著です。 HCLガスは溶液から逃げ、濃度の減少と刺激臭を引き起こします。
* 純粋な化合物としてのガスオフ: HCLは、室温と圧力のガスです。したがって、コンテナに純粋なHClがある場合、それはガス状の形になります。
硫酸(H₂SO₄):
* ソリューションでガスオフ: 濃縮硫酸(通常98%)はHClよりも揮発性が低い。ただし、強く加熱すると、硫黄3酸化硫黄(SO₃)ガスを放出する可能性があります。この反応は可逆的であり、動的平衡を形成します。
h₂so₄(l)⇌(g) +h₂o(l)
* 純粋な化合物としてのガスオフ: 純粋な硫酸は室温で液体です。 HCLと同じように「ガスオフ」しません。
重要な違い:
* ボラティリティ: HClはH₂SO₄よりも揮発性です。つまり、特定の温度で蒸発する傾向が高くなります。
* 平衡: 硫酸と三酸化硫黄の間の平衡は、低温での液相に有利です。ただし、加熱すると、平衡は気相に向かってシフトし、SO₃が放出されます。
要約:
両方の酸は特定の条件下で「ガスをオフ」することができますが、HCLはそのボラティリティのために通常の温度でそうする傾向があります。 硫酸はガスを放出するためにより高い温度を必要とし、それでも酸性分子全体ではなく三酸化硫黄を放出する可能性が高くなります。