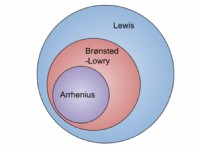
* 電子構成: 金属は一般に、最も外側の殻(価電子)にいくつかの電子を持っています。これらの電子は比較的ゆるく保持されており、簡単に除去できます。
* オクテットルール: 原子は、完全な外側シェル(通常は8電子)を持つ貴族のような安定した電子構成を実現するよう努めています。電子を失うと、金属が安定した電子構成を実現することができ、多くの場合、完全な外側のシェルをもたらします。
* 電気促進性: 金属は電気依存症です。つまり、電子を失う傾向が強いことを意味します。これは、電子を原子から除去するために必要なエネルギーであるイオン化エネルギーが比較的低いためです。
簡単な例:
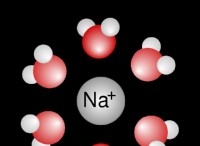
* ナトリウム(Na): ナトリウムには1つの価電子があります。この電子を失うことにより、それはneon(NE)のような安定した電子構成を持つ陽イオンであるNa+になります。
要約:
金属は、電子を失い、陽イオンを形成する可能性が高くなります。
*彼らはゆるく保持された原子価電子を持っています。
*電子を失うと、安定した電子構成を実現できます。
*それらは電気依存症であり、電子を失うのが容易です。
重要な注意: ほとんどの金属は陽イオンを形成しますが、例外があります。たとえば、一部の金属は、特定の状況で陰イオン(負に帯電したイオン)を形成できます。